
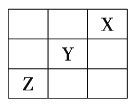
【题目】元素![]() 、
、![]() 、
、![]() 在周期表中的相对位置如图所示。已知
在周期表中的相对位置如图所示。已知![]() 元素原子的外围电子排布式为
元素原子的外围电子排布式为![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )
A.![]() 元素原子的价电子排布式为
元素原子的价电子排布式为![]()
B.![]() 元素在元素周期表的第三周期第ⅥA族
元素在元素周期表的第三周期第ⅥA族
C.![]() 元素所在周期中所含非金属元素最多
元素所在周期中所含非金属元素最多
D.![]() 元素原子的核外电子排布式为
元素原子的核外电子排布式为![]()
【答案】A
【解析】
Y元素原子的外围电子排布为nsn1npn+1,s能级最多容纳2个电子,故n1=2,解得n=3,故Y元素原子的外围电子排布为3s23p4,Y为S元素,由X、Y、Z在周期表中的位置可知,X为F元素,Z为As元素。
A.Y元素原子的外围电子排布为nsn1npn+1,s能级最多容纳2个电子,故n1=2,解得n=3,故Y元素原子的外围电子排布为3s23p4,故A错误;
B.Y为S元素,处于第三周期第ⅥA族,故B正确;
C.X为F元素,处于第二周期,只有2两种金属元素,含有6种非金属元素,含非金属元素最多,故C正确;
D.Z为As元素,是33号元素,其元素原子的核外电子排布式为![]() ,故D正确;
,故D正确;
答案选A。


科目:高中化学 来源: 题型:
【题目】煤的工业加工过程中,可利用CO和H2合成甲醇,能量变化如图所示。下列说法正确的是
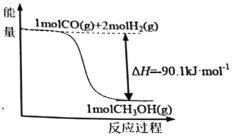
A.该反应是吸热反应
B.1molCH3OH所具有的能量为90.1kJ
C.CO(g)+2H2(g)![]() CH3OH(l) ΔH=-90.1kJ·mol-1
CH3OH(l) ΔH=-90.1kJ·mol-1
D.1molCO和2molH2断键所需能量小于1molCH3OH断键所需能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过二硫酸铵[(NH4)2S2O8]是一种常用的氧化剂和漂白剂。一种以辉铜矿(主要成分为Cu2S,且杂质不参与下列流程中的反应)为原料制备过二硫酸铵的流程如图所示:
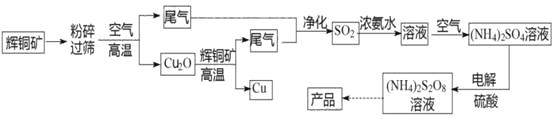
请回答下列问题:
(1)矿石“粉碎”的目的是________
(2)Cu2O和辉铜矿在高温下反应的化学方程式为________。在该反应中,n(氧化剂):n(还原剂)=________。
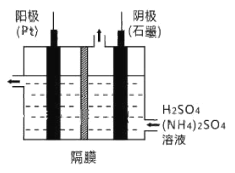
(3)工业上,常采用电解法制取(NH4)2S2O8,其装置如下图所示。则电解时,阳极的电极反应式为:________。当电路中转移2.5mol电子时,阴极产生________(填数值)mol________(填物质)。
(4)从过二硫酸铵溶液中获得过二硫酸铵晶体,需采用蒸发浓缩、降温结晶、________、________、干燥等操作。
(5)过二硫酸铵常用于检验废水中的Cr3+是否超标,如果超标,溶液会变成橙色(还原产物为SO42-),写出该反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关电解质溶液中微粒的物质的量浓度关系不正确的是
A.等浓度的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液中的c(![]() ):①>③>②
):①>③>②
B.等体积pH=a的醋酸与pH=b的NaOH溶液(a+b=14)充分混合时,可能有:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.已知Ka(HClO)=3.0×10-8,Ka(HCN)=6.2×10-10,等体积、等浓度的NaClO、NaCN溶液中,前者中的离子总数小于后者中的离子总数
D.向20mL氨水中加入10mL等浓度的盐酸,有c(![]() )-c(NH3H2O)=2[c(OH-)-c(H+)]
)-c(NH3H2O)=2[c(OH-)-c(H+)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种过渡金属元素,它具有强度高、熔点高、耐腐蚀等优点,被广泛应用于钢铁、石油、化工、电气等领域。钼酸钠晶体(Na2MoO42H2O)是一种新型水处理剂。某化学兴趣小组利用废钼催化剂(主要成分为MoS2,含少量Cu2S、FeS2)回收Mo并制备钼酸钠晶体,其主要流程如图所示:
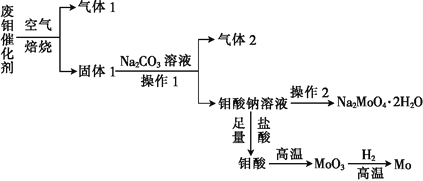
回答下列问题:
(1)可以提高焙烧效率的措施有__________________(填一条即可)。MoS2中的钼元素在空气中焙烧,很容易被氧化成MoO3,若生成0.1molMoO3,则反应中转移电子的数目为______。
(2)往固体1中加碳酸钠溶液,发生反应的化学方程式为_______________。
(3)操作2为______________、洗涤、干燥。
(4)制备钼酸钠晶体还可通过向精制的MoS2中直接加入次氯酸钠溶液与氢氧化钠溶液进行氧化的方法,若氧化过程中还有硫酸钠生成,则反应的离子方程式为___________。
(5)已知钼酸钠溶液中c(MoO42-)=0.40mol/L,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-,当BaMoO4开始沉淀时,溶液中c(CO32-)=_________[已知:Ksp(BaCO3)=2.6×10-9,Ksp(Ba MoO4)=4.0×10-8。忽略溶液的体积变化]。
(6)锂和二硫化钼形成的二次电池的总反应为xLi+nMoS2![]() Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为____。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,33.6LHF中含有氟原子的数目为1.5NA
B.2.8gCO与C2H4的混合气体中所含分子数为0.1NA
C.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
D.含1molFeCl3的氯化铁溶液完全水解生成Fe(OH)3胶体,其中胶粒数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铵(NH4H)与氯化铵结构相似。已知NH4H与水反应有氢气产生,则下列叙述不正确的是
A.NH4H的电子式是:
B.NH4H固体投入少量水中,有两种气体产生
C.NH4H中的H-离子半径比锂离子半径大
D.NH4H溶于水后,形成的溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设计将两根铂丝做电极插入到KOH溶液中,然后在两极上分别通过甲烷和氧气而构成燃料电池。该电池中反应的化学方程式为:CH4+2O2+2KOH![]() K2CO3+3H2O,则关于此燃料电池的下列说法中错误的是(1个电子所带电量为1.6×10-19C)
K2CO3+3H2O,则关于此燃料电池的下列说法中错误的是(1个电子所带电量为1.6×10-19C)
A.通过甲烷的电极为电池的负极,通过氧气的电极为正极
B.在标准状况下,每消耗5.6 L O2,可向外提供2.4×104C的电量
C.通过甲烷电极的电极反应为:CH4+10OH--8e-![]() CO32-+7H2O
CO32-+7H2O
D.放电一段时间后,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍。现以A为主要原料合成F和高分子化合物E,其合成路线如图所示。

(1)A的结构式为__________,B中决定其性质的重要官能团的名称为____________。
(2)写出反应的化学方程式并判断反应类型。
①____________________________________反应类型:__________。
②_____________________________________反应类型:__________。
(3)实验室怎样鉴别B和D?_________________________。
(4)在实验室里我们可以用如下图所示的装置来制取F,乙中所盛的试剂为_______,该溶液的主要作用是_____________________________________;
(5)该装置图中有一个明显的错误是_____________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com