
【题目】25℃时,下列有关电解质溶液中微粒的物质的量浓度关系不正确的是
A.等浓度的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液中的c(![]() ):①>③>②
):①>③>②
B.等体积pH=a的醋酸与pH=b的NaOH溶液(a+b=14)充分混合时,可能有:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.已知Ka(HClO)=3.0×10-8,Ka(HCN)=6.2×10-10,等体积、等浓度的NaClO、NaCN溶液中,前者中的离子总数小于后者中的离子总数
D.向20mL氨水中加入10mL等浓度的盐酸,有c(![]() )-c(NH3H2O)=2[c(OH-)-c(H+)]
)-c(NH3H2O)=2[c(OH-)-c(H+)]
【答案】C
【解析】
A.等浓度的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液中的c(![]() ):从电离方程式看,①中c(
):从电离方程式看,①中c(![]() )比③中的2倍还大,③中
)比③中的2倍还大,③中![]() 单水解,而②中阴、阳离子水解相互促进,c(
单水解,而②中阴、阳离子水解相互促进,c(![]() )③>②,所以c(
)③>②,所以c(![]() ):①>③>②,A正确;
):①>③>②,A正确;
B.等体积pH=a的醋酸与pH=b的NaOH溶液(a+b=14)充分混合时,溶液中的H+与OH-刚好完全反应,由于醋酸过量,所以反应后醋酸电离,从而使溶液显酸性,且c(CH3COO-)>c(Na+),所以有:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),B正确;
C.等体积、等浓度的NaClO、NaCN溶液中,c(Na+)+ c(ClO-)+ c(OH-)(酸根离子水解产生)= c(Na+)+ c(CN-)+c(OH-)(酸根离子水解产生),但由于NaCN溶液的碱性强,c(H+)小,所以前者中的离子总数大于后者中的离子总数,C不正确;
D.向20mL氨水中加入10mL等浓度的盐酸,生成NH4Cl和H2O,且c(![]() )=c(NH3H2O),此时NH3H2O再发生电离,于是溶液中存在以下平衡:NH3·H2O
)=c(NH3H2O),此时NH3H2O再发生电离,于是溶液中存在以下平衡:NH3·H2O![]()
![]() + OH-、H2O
+ OH-、H2O![]() H++OH-,有c(
H++OH-,有c(![]() )-c(NH3H2O)=2[c(OH-)-c(H+)],D正确;
)-c(NH3H2O)=2[c(OH-)-c(H+)],D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】实验室中用氯气与粗铜![]() 杂质只有Fe)反应,制备CuCl2·2H2O晶体的流程如下
杂质只有Fe)反应,制备CuCl2·2H2O晶体的流程如下

已知:氯化铜从水溶液中结晶时,所得晶体CuCl2·2H2O与温度关系如下
温度 | 小于15℃ | 15—25.7℃ | 26—42℃ | 42—100℃ | 100℃以上 |
晶体 | CuCl2·4H2O | CuCl2·3H2O | CuCl2·2H2O | CuCl2·H2O | CuCl2 |
下列说法不正确的是
A.制备氯气的反应:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
B.由溶液乙制备纯净CuCl2·2H2O晶体的系列操作步骤为:加少量盐酸、蒸发浓缩、冷却到室温结晶、过滤、洗涤、干燥。
C.固体乙是氢氧化铁
D.此流程中溶解固体甲的酸只能是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组探究氯与水反应的热效应及所得溶液氯元素含量,查阅大量资料并做下列实验探究验证
实验Ⅰ:在通风橱内向装有80mL蒸馏水的锥形瓶![]() 瓶口塞上棉花团
瓶口塞上棉花团![]() 中鼓入氯气,至溶液中pH没有明显变化停止通入氯气,使用数据采集器,测定在此过程中溶液的温度及pH变化,具体数据如图所示:
中鼓入氯气,至溶液中pH没有明显变化停止通入氯气,使用数据采集器,测定在此过程中溶液的温度及pH变化,具体数据如图所示:
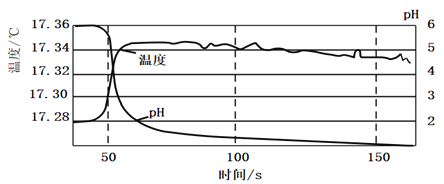
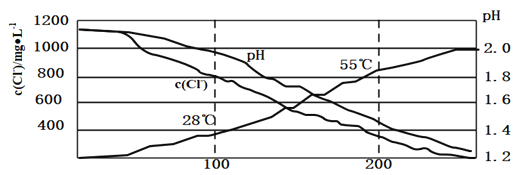
实验Ⅱ:对20mL饱和氯水加热,测出c(Cl—)、pH及温度变化如图2所示。
实验Ⅲ:采用莫尔法测定氯水中氯元素的含量。此法是以![]() 为指示剂,用
为指示剂,用![]() 标准溶液进行滴定。其实验步骤如下:
标准溶液进行滴定。其实验步骤如下:
①准确移取25.00ml氯水试样3份,分别置于锥形瓶中,再分别加入25.00ml水;
②向试样中加入足量的![]() 溶液;
溶液;
③除去过量的![]() ,冷却;
,冷却;
④调整溶液的pH,再加入![]()
![]() 溶液,在不断摇动下用
溶液,在不断摇动下用![]()
![]()
![]() 标准溶液滴定至溶液呈砖红色
标准溶液滴定至溶液呈砖红色![]()
![]() 砖红色
砖红色![]() ]
]
⑤重复上述实验,测得消耗![]() 标准溶液体积的平均值为vmL
标准溶液体积的平均值为vmL
回答下列问题:
(1)氯气在295K、100Kpa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。该反应的离子方程式为______;估算该离子反应的平衡常数______
(2)根据实验Ⅰ测定结果判断氯气与水的反应是______![]() 填“吸热反应”或“放热反应”
填“吸热反应”或“放热反应”![]() 理由是______
理由是______
(2)分析实验Ⅱ图,小组同学推测产生该结果的原因可能是多种反应造成的,下列叙述合理的是______
A.升温,氯气挥发导致c(Cl—)减小
B.对于![]() 和
和![]() 的反应,升温平衡逆向移动,c(Cl—)减小,pH减小
的反应,升温平衡逆向移动,c(Cl—)减小,pH减小
C.升温,促进次氯酸分解2HClO![]() 2HCl+O2↑
2HCl+O2↑
D.升温,可能发生3HClO![]() 2HCl+HClO3(强酸) ,使得pH减小
2HCl+HClO3(强酸) ,使得pH减小
(4)实验Ⅲ步骤3中加足量的![]() 溶液,目的是______
溶液,目的是______
(5)用![]() 标准溶液滴定氯离子达到化学计量点时,
标准溶液滴定氯离子达到化学计量点时,![]() ,若此时要求不生成
,若此时要求不生成![]() 沉淀,则
沉淀,则![]() 最大不能超过______
最大不能超过______![]() 已知:
已知:![]() ,
,![]()
(6)计算实验Ⅲ氯水中氯元素的含量,列出算式:______![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置由甲、乙部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源。当电池工作时,下列说法正确的是

A. 电子的流动方向M→Fe→CuSO4溶液→Cu-N
B. M极电极反应式: H2N(CH2)2NH2+16OH--16e-==2CO2↑+N2↑+12H2O
C. 当N极消耗5.6LO2时,则铁极增重32g
D. 一段时间后,乙中CuSO4溶液浓度基本保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.电解精炼铜时,电解液CuSO4溶液的物质的量浓度不变
B.NaClO溶液中通入少量CO2后,ClO-水解程度增大,溶液碱性增强
C.SO3(g)+H2O(l)=H2SO4(aq)在常温下能自发进行,则该反应的△H<0
D.0.1 mo1·L-1CH3COOH溶液加水稀释后,溶液中![]() 的值减小
的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗铜精炼后的阳极泥中含有Cu、Au(金)和PbSO4等杂质,湿法处理阳极泥进行综合利用的工艺流程如图所示:
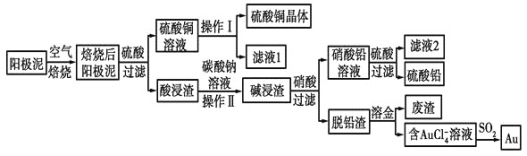
(1)电解精炼含铜、金、铅的粗铜时,电解液应该用________溶液作电解液,电解时阳极的电极反应式为___________________________和Cu-2e-=Cu2+。
(2)完成操作Ⅰ的主要步骤有:__________________,过滤,洗涤,干燥。
(3)写出用SO2还原AuCl4-的离子反应方程式____________________________。
(4)为了减少废液排放、充分利用有用资源,工业上将滤液1并入硫酸铜溶液进行循环操作,请指出流程图中另一处类似的做法________________________。
(5)用离子方程式表示加入碳酸钠溶液的作用:___________________________。[已知298K时,Ksp(PbCO3)=1.46×10-13,Ksp(PbSO4)=1.82×10-8]。当溶液中c(SO42-)=0.2mol/L时,c(CO32-)=________mol/L。![]() 结果保留2位有效数字
结果保留2位有效数字![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素![]() 、
、![]() 、
、![]() 在周期表中的相对位置如图所示。已知
在周期表中的相对位置如图所示。已知![]() 元素原子的外围电子排布式为
元素原子的外围电子排布式为![]() ,则下列说法不正确的是( )
,则下列说法不正确的是( )
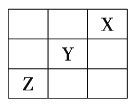
A.![]() 元素原子的价电子排布式为
元素原子的价电子排布式为![]()
B.![]() 元素在元素周期表的第三周期第ⅥA族
元素在元素周期表的第三周期第ⅥA族
C.![]() 元素所在周期中所含非金属元素最多
元素所在周期中所含非金属元素最多
D.![]() 元素原子的核外电子排布式为
元素原子的核外电子排布式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
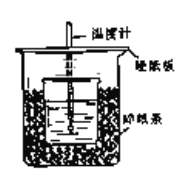
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________________;由图可知该装置有不妥之处,应如何改正?___________________________________________________.
(2)烧杯间填满碎塑料泡沫的作用是__________________________________________.
(3)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求得的中和热数值___________(填“相等、不相等”)
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会____________(填“偏大”、“偏小”、“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮(N)、磷(P)、砷(As)等都是ⅤA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)化合物N2H4的电子式为___________________。
(2)As原子的核外电子排布式为_______________________。
(3)P和S是同一周期的两种元素,P的第一电离能比S大,原因是_______________。
(4)NH4+中H-N-H的健角比NH3中H-N-H的键角大,原因是_________________。
(5)Na3AsO4中含有的化学键类型包括________;AsO43-空间构型为________,As4O6的分子结构如图所示,则在该化合物中As的杂化方式是________________。

(6)白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。己知晶胞的边长为acm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为_________,该晶体的密度为_______g·cm-3(用含NA、a的式子表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com