
【题目】粗铜精炼后的阳极泥中含有Cu、Au(金)和PbSO4等杂质,湿法处理阳极泥进行综合利用的工艺流程如图所示:
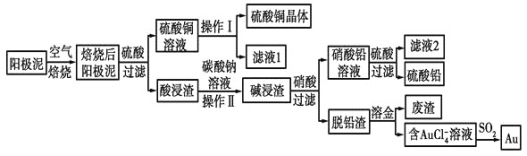
(1)电解精炼含铜、金、铅的粗铜时,电解液应该用________溶液作电解液,电解时阳极的电极反应式为___________________________和Cu-2e-=Cu2+。
(2)完成操作Ⅰ的主要步骤有:__________________,过滤,洗涤,干燥。
(3)写出用SO2还原AuCl4-的离子反应方程式____________________________。
(4)为了减少废液排放、充分利用有用资源,工业上将滤液1并入硫酸铜溶液进行循环操作,请指出流程图中另一处类似的做法________________________。
(5)用离子方程式表示加入碳酸钠溶液的作用:___________________________。[已知298K时,Ksp(PbCO3)=1.46×10-13,Ksp(PbSO4)=1.82×10-8]。当溶液中c(SO42-)=0.2mol/L时,c(CO32-)=________mol/L。![]() 结果保留2位有效数字
结果保留2位有效数字![]()
【答案】CuSO4 Pb-2e-+SO42-=PbSO4 蒸发浓缩,降温结晶 2AuCl4-+3SO2+6H2O=2Au+3SO42-+8Cl-+12H+ 用滤液2溶解碱浸渣(或并入硝酸中溶解碱浸渣) PbSO4(s)+CO32-(aq)PbCO3(s)+SO42-(aq) 1.6×10-6
【解析】
粗铜精炼后的阳极泥含有Cu、Au(金)和PbSO4等杂质,焙烧后金属铜成为氧化铜,酸浸可以得到硫酸铜溶液,硫酸铜溶液经过蒸发浓缩,降温结晶,过滤、洗涤,干燥获得硫酸铜晶体;Au(金)和PbSO4等杂质经碳酸钠浸洗、浓硝酸氧化后,过滤得到硝酸铅溶液,滤液加硫酸生成硫酸铅沉淀,再过滤得到硫酸铅;脱铅滤渣主要是金,加王水溶金,得到含有AuCl4-的溶液,AuCl4-可以被SO2还原得到Au。
(1)电解精炼粗铜时一般用硫酸铜溶液作电解质溶液;电解精炼的粗铜作阳极会发生氧化反应,其中单质铜和活泼性比Cu强的金属都会发生溶解,因此粗铜中的铜和铅会发生失电子的氧化反应,电极反应式为:Pb-2e-+SO42-=PbSO4;
(2)操作I的步骤是从硫酸铜溶液中获得硫酸铜晶体,因此该步骤是蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤,操作II是从酸浸渣(PbSO4)中得到碱浸渣(PbCO3),因此该操作是过滤操作;
(3)SO2还原AuCl4-中还原剂和氧化剂都比较明确,因此很容易推测出氧化产物是SO42-,还原产物是Au,根据氧化还原反应得失电子守恒先缺项配平,然后根据电荷守恒再配平,因此得到的反应方程式为:2AuCl4-+3SO2+6H2O=2Au+3SO42-+8Cl-+12H+;
(4)滤液1是在结晶硫酸铜时剩下的滤液,还含有少量的未析出的硫酸铜,因此并入前面的硫酸铜溶液进行循环,有利于充分利用,因此类似此处的做法,应该是流程中得到的另一滤液2,此滤液2是在硝酸铅溶液中加入硫酸生成硫酸铅沉淀并过滤出硫酸铅后剩下的溶液,此溶液中H+没有发生反应,因此还有大量的硝酸溶液,所以可以把此滤液当成硝酸加入前面的碱浸渣中溶解碱浸渣;
(5)通过比较两种沉淀的溶度积,可以看出碳酸铅比硫酸铅更加难溶,因此往硫酸铅中加入碳酸钠,发生的是沉淀溶解转化的反应,离子方程式要注意标明状态,方程式为:PbSO4(s)+CO32-(aq)PbCO3(s)+SO42-(aq),已知298K时,当溶液中c(SO42-)=0.2mol/L,Ksp(PbSO4)=1.82×10-8时,c(Pb2+)=9.1×10-8mol/L,Ksp(PbCO3)=1.46×10-13,c(CO32-)=1.6×10-6mol/L。


科目:高中化学 来源: 题型:
【题目】下列关于蔗糖属于非还原性糖,而其水解产物具有还原性的实验方案的说法正确的是( )。
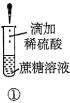
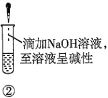
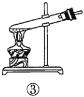
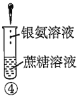
A.验证蔗糖属于非还原性糖的操作顺序:④③
B.验证蔗糖風于非还原性糖的操作顺序:④②③
C.验证蔗糖水解产物具有还原性的操作顺序:①④⑤
D.验证蔗糖水解产物具有还原性的操作顺序:①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
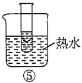
【题目】下列实验能达到实验目的的是
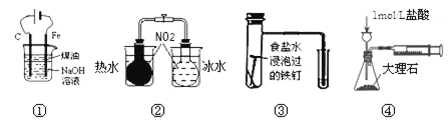
A.用图①装置制备Fe(OH)2并能较长时间观察其颜色
B.用图②装置探究温度对平衡移动的影响
C.用图③装置验证铁发生析氢腐蚀
D.用图④装置测定反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,从精制黑钨矿(FeWO4、MnWO4)中提取金属钨的一种流程如下图所示,该流程同时获取副产物Fe2O3和MnCl2。

已知:I.过程①~④中,钨的化合价均不变;
Ⅱ.常温下钨酸难溶于水;
Ⅲ.25℃时,Ksp[Fe(OH)3]=1.0×10-38,Ksp [Mn(OH)2]=4.0×10-14
回答下列问题:
(1)上述流程中的“滤渣1”除MnO2外还有_____、“气体”除水蒸气、HCl外还有____(均填化学式);
(2)过程①中MnWO4参与反应的化学方程式为______;FeWO4参与的反应中氧化剂与还原剂的物质的量之比为___________;
(3)已知WO3(s)+3H2(g)=W(s)+3H2O(g) ΔH=a kJ·mol-1
WO3(s)=WO3(g) ΔH=b kJ·mol-1
写出WO3(g)与H2(g)反应生成W(s)的热化学方程式:_______;
(4)过程⑦在25℃时调pH,至少应调至_______(当离子浓度等于1.0×10-5mol·L-1时,可认为其已沉淀完全);
(5)过程⑧要获得MnCl2固体,在加热时必须同时采取的一项措施是__________;
(6)钠钨青铜是一类特殊的非化学计量比化合物,其通式为NaxWO3,其中0<x<1,这类化合物具有特殊的物理化学性质,是一种低温超导体。应用惰性电极电解熔融的Na2WO4和WO2混合物可以制备钠钨青铜,写出WO42-在阴极上放电的电极反应式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关电解质溶液中微粒的物质的量浓度关系不正确的是
A.等浓度的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液中的c(![]() ):①>③>②
):①>③>②
B.等体积pH=a的醋酸与pH=b的NaOH溶液(a+b=14)充分混合时,可能有:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.已知Ka(HClO)=3.0×10-8,Ka(HCN)=6.2×10-10,等体积、等浓度的NaClO、NaCN溶液中,前者中的离子总数小于后者中的离子总数
D.向20mL氨水中加入10mL等浓度的盐酸,有c(![]() )-c(NH3H2O)=2[c(OH-)-c(H+)]
)-c(NH3H2O)=2[c(OH-)-c(H+)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)Na2CO3溶液显碱性的原因,用离子反应方程式表示_____________________________;CuSO4溶液呈酸性的原因,用离子反应方程式表示:___________________________。
(2)25 ℃时,pH为9的CH3COONa溶液中c(OH-)=________。
(3)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH![]() )=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=___________。
)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,33.6LHF中含有氟原子的数目为1.5NA
B.2.8gCO与C2H4的混合气体中所含分子数为0.1NA
C.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
D.含1molFeCl3的氯化铁溶液完全水解生成Fe(OH)3胶体,其中胶粒数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁的电化学腐蚀原理如图所示,下列有关说法中错误的是( )
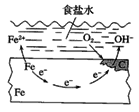
A. 铁片里的铁和碳与食盐水形成无数的微小原电池
B. 铁电极发生氧化反应
C. 负极的电极反应方程式为O2+4e-+2H2O=4OH-
D. 放置一段时间后,铁片上有铁锈出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,在A处通入未经干燥的氯气。当关闭B阀时,C处的红布条看不到明显现象;当打开B阀后,C处的红布条逐渐褪色。则D瓶中盛放的溶液不可能是( )
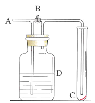
A.饱和NaCl溶液B.NaOH溶液C.NaBr溶液D.浓H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com