
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
化学工作者把烷烃、烯烃、环烷烃、炔烃的通式转化成键数的通式,给研究有机物分子中键能大小的规律带来了很大的方便。设键数为I,则烷烃中碳原子跟键数关系的通式为CnI3n+1,烯烃(视双键为两条单键)及环烷烃中碳原子跟键数关系的通式均为CnI3n,则苯的同系物中碳原子跟键数关系的通式为 ( )
A CnI3n-1 B CnI3n-2 C CnI3n-3 D CnI3n-4
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学——物质结构与性质](1 5分)
四种短周期元素A、13、C、D的原子序数依次递增.其中A、B、C二种元素基态原子的2p能级上都有未成对电子.且术成对电子个数分别是2、3、2;D与C 可以形成D2C和D2C2两种化合物。回答下列问题:
(1)已知A元素与氢元素形成的某种气态化合物在标准状况下的密度为1.1 6 1 g·L-1,则在该化合物的分子中A原子的杂化方式为 。
(2)A、B、C二种元素的第一电离能由小到大的顺序为 (填元素符号)。
 (3)+1价气态基态阳离子再欠去一个电子形成+2价气态基态阳离子所需
(3)+1价气态基态阳离子再欠去一个电子形成+2价气态基态阳离子所需
要的能量称为第二电离能I2,依次还有I3、I4、I5……,推测D元素的电
离能第一次突增应出现在第电离能。
(4)AC2在高温高压下所形成的晶体其晶胞如图所示。该晶体的类型属于 晶
体.该品体中A原子轨道的杂化类型为 。
 (5)C和C形成原子个数比为1:3的常见离子.推测这两种微粒的空间
(5)C和C形成原子个数比为1:3的常见离子.推测这两种微粒的空间
构型为 。
(6)C和D形成的一种离子化合物D2C的品胞结构如图所示.该晶体中阳
离子的配位数为 。距一个阴离子周围最近的所有阳离子为顶点构成
的几何体为 。
已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA.则晶胞边长a= cm(用含ρ、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列元素的半径为:
| 原子 | N | S | O | Si |
| 半径r/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,磷原子的半径可能是( )
A.1.10×10-10m B.0.80×10-10m C.1.20×10-10m D.0.70×10-10m
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组微粒具有相同的质子数和电子数的是( )
A.OH-、H2O、F- B.NH3、NH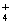 、NH
、NH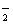
C.H3O+、NH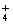 、NH
、NH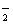 D.HCl、F2、H2S
D.HCl、F2、H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关原子结构和元素周期律的表述正确的是( )
①原子序数为15的元素的最高化合价为+3 ②ⅦA族元素是同周期中非金属性最强的元素 ③第二周期ⅣA族元素的原子核电荷数和中子数一定为6 ④原子序数为12的元素位于元素周期表的第三周期ⅡA族
A.①② B.①③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端
 科学特别是信息领域有着广泛的用途。试回答下列问题:
科学特别是信息领域有着广泛的用途。试回答下列问题:
(1)基态锗原子的价电子排布式为_________________________________。
(2)沸点:NH3________AsH3(填“>”、“<”或“=”,原因是______________
____________________________________________________________________.
(3)某砷的氧化物俗称“砒霜”,其分子结构如右图所示,该化合物的分子式
为_______________,As原子采取__________________杂化。
 (4) H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3酸性强的原因_________________________________________________ 。
(4) H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3酸性强的原因_________________________________________________ 。
(5)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,反应的方程式
为_________________;砷化镓的晶胞结构如下图所示,其晶胞边长为a pm,
则每立方厘米该晶体中所含砷元素的质量为____________g(用 表示阿伏
表示阿伏
加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com