
分析 根据n=$\frac{m}{M}$计算S042-的物质的量,根据电荷守恒3n(Fe3+)=2n(SO42-),据此计算n(Fe3+),再根据c=$\frac{n}{V}$计算Fe3+的浓度.
解答 解:ag S042-的物质的量为$\frac{ag}{96g/mol}$=$\frac{a}{96}$mol,
根据电荷守恒3n(Fe3+)=2n(SO42-),所以n(Fe3+)=$\frac{2}{3}$n(S042-)=$\frac{2}{3}$×$\frac{a}{96}$mol=$\frac{a}{144}$mol,
故溶液中Fe3+的浓度为:$\frac{\frac{a}{144}mol}{VL}$=$\frac{a}{144V}$mol/L,
故答案为:$\frac{a}{144V}$mol/L.
点评 本题考查物质的量浓度的有关计算,为高频考点,侧重学生的分析能力和计算能力的考查,难度不大,计算硫酸根的物质的量是关键,注意对物质的量浓度定义式的理解.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
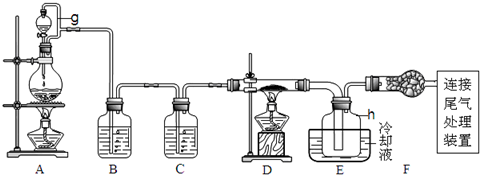
| 物质 | SiCl4 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | - | 315 | - |
| 熔点/℃ | -70.0 | - | - | - |
| 升华温度/℃ | - | 180 | 300 | 162 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤(不要求写出具体操作过程) | 与其的实验现象和结论 |
| 将所得沉淀过滤、洗涤… | 颜色变成褐色,说明含有Mn(OH)2 |
| 取少量沉淀于试管中,假如足量的盐酸,观察现象 | 没有气泡生成,说明不含MnCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 淀粉通过下列转化可以得到多种有机物
淀粉通过下列转化可以得到多种有机物查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com