
【题目】向碳酸溶液中滴加NaOH溶液,测得碳酸中含碳微粒的物质的量分数随pH变化如下图所示,下列说法不正确的是
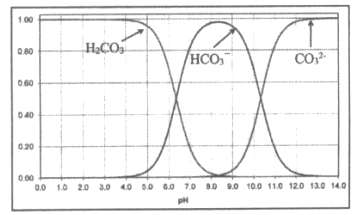
A.人体血液的pH=7.35~7.45,其中含碳微粒以HCO3-、H2CO3为主
B.除去NaCl溶液中Na2CO3的方法是向其中加入盐酸至pH=7
C.pH=10的溶液中c(H+)+c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.将CO2通入NaOH溶液制取Na2CO3,应大约控制pH>12.5
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡金属元素。A、B、C同周期,C、D同主族,A的原子结构示意图为 ,B的核外电子排布式为1s22s22p63s1,C的最外层有三个未成对电子,E的价电子排布式为3d64s2。试回答下列问题:
,B的核外电子排布式为1s22s22p63s1,C的最外层有三个未成对电子,E的价电子排布式为3d64s2。试回答下列问题:
(1)写出下列元素的名称:A__________,C________。
(2)E元素原子的未成对电子数是________,E元素在周期表中位于第________周期______族;已知元素周期表可按电子排布分为s区、p区、d区等,则E元素在______区。
(3)画出D的核外电子排布图:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
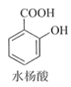 +(CH3CO)2O(醋酸酐)
+(CH3CO)2O(醋酸酐)![]()
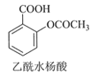 +CH3COOH
+CH3COOH
水杨酸 | 醋酸酐 | 乙酰水杨酸 | |
熔点/℃ | 157~159 | 72~ 74 | 135~138 |
相对密度/(g · cm3) | 1.44 | 1.10 | 1.35 |
相对分子质量 | 138 | 102 | 180 |
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右, 充分反应。稍冷后进行如下操作:
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。回答下列问题:
(1)该合成反应中应采用_____加热。(填标号)
A 热水浴 B 酒精灯 C 煤气灯 D 电炉
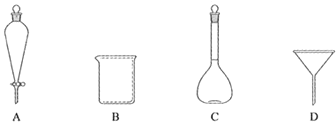
(2)下列玻璃仪器中,①中需使用的有_____(填标号)。
(3)①中需使用冷水,目的是_____。
(4)②中饱和碳酸氢钠的作用是_____,以便过滤除去难溶杂质。
(5)④采用的纯化方法为_____。
(6)本实验的产率是_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是典型微生物燃料电池原理示意图。若用含硝酸盐废水替代图中氧气,可达到废水处理的目的(已知:a室中微生物降解有机物产生e-、CO2和H+)。关于该电池,下列说法不正确的是
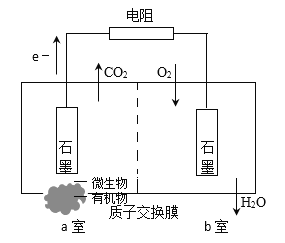
A.H+通过质子交换膜从a室进入b室
B.a室内发生氧化反应,电极为正极
C.b室内发生的电极反应为:O2+4e-+4H+=2H2O
D.将硝酸盐转化为N2时,电极反应为:2NO3-+10e-+12H+=N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①Ar ②Na2O2 ③CCl4 ④HClO ⑤N2 ⑥MgF2 ⑦NH4Cl
(1)只存在共价键的是_______,不存在化学键的是_______,离子化合物有________。
(2)NH4Cl的电子式为_________。
(3)用电子式表示MgF2的形成过程___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学设计了如图装置制取溴苯和溴乙烷:
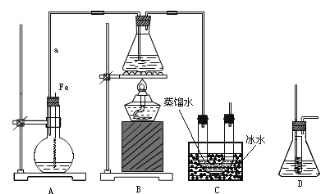
已知:乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下 表所示:
溶解性(本身均可作溶剂) | 沸点(℃) | 密度(g/mL) | |
乙醇 | 与水互溶,易溶于有机溶剂 | 78.5 | 0.8 |
溴乙烷 | 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
请回答下列问题:
(1)B中发生反应生成目标产物的化学方程式为______。
(2)导管a的作用是______。
(3)反应完毕后,U形管内的现象是______;分离溴乙烷时所需的玻璃仪器是______。
(4)简述实验中用纯铁丝代替铁粉的优点:______。
(5)实验完成后,某同学在溴乙烷中加入NaOH乙醇溶液并加热,为判断其发生的是水解 反应还是消去反应,该同学设计了甲、乙两个方案:
方案甲:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应
方案乙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则证明发生了消去反应。
则有关上述实验方案的叙述(_____)
A 方案甲正确 B 方案乙正确 C 两个方案都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备:C4H10(g)![]() C4H8(g)+H2(g) △H。该反应平衡转化率、反应温度及压强的关系如图,下列说法正确的是
C4H8(g)+H2(g) △H。该反应平衡转化率、反应温度及压强的关系如图,下列说法正确的是
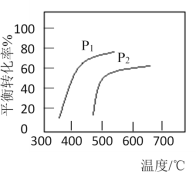
A.该反应△S<0
B.压强P1<P2
C.该反应为吸热反应,平衡常数随温度升高而降低
D.使用催化剂可加快反应速率,使平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋约占地球表面积的71%,海水资源的利用前景广阔,从海水中提取镁的主要步骤如图所示,下列说法正确的是
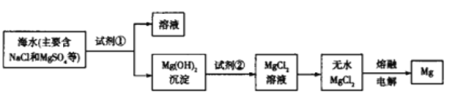
A.工业上利用NaOH溶液使Mg2+转化为Mg(OH)2
B.与Mg同周期的金属都可以采用电解熔融的无水氯化物来制备
C.试剂②可以选用盐酸
D.工业上也可以将Mg(OH)2煅烧分解为MgO,通过电解熔融MgO制取Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com