
【题目】乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
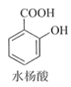 +(CH3CO)2O(醋酸酐)
+(CH3CO)2O(醋酸酐)![]()
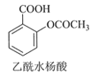 +CH3COOH
+CH3COOH
水杨酸 | 醋酸酐 | 乙酰水杨酸 | |
熔点/℃ | 157~159 | 72~ 74 | 135~138 |
相对密度/(g · cm3) | 1.44 | 1.10 | 1.35 |
相对分子质量 | 138 | 102 | 180 |
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右, 充分反应。稍冷后进行如下操作:
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。回答下列问题:
(1)该合成反应中应采用_____加热。(填标号)
A 热水浴 B 酒精灯 C 煤气灯 D 电炉
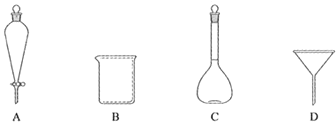
(2)下列玻璃仪器中,①中需使用的有_____(填标号)。
(3)①中需使用冷水,目的是_____。
(4)②中饱和碳酸氢钠的作用是_____,以便过滤除去难溶杂质。
(5)④采用的纯化方法为_____。
(6)本实验的产率是_____%。
【答案】A BD; 充分析出乙酰水杨酸固体(结晶) 生成可溶的乙酰水杨酸钠 重结晶 60
【解析】
(1)低于100°的加热需要水浴加热,该合成温度为70℃左右,所以该合成反应中应采用热水浴,BCD加热温度都高于100℃,故答案为:A;
(2)①中操作为过滤,需要的玻璃仪器有玻璃棒、普通漏斗、烧杯,所以选取BD仪器,故答案为:BD;
(3)乙酰水杨酸在常温下是固体,且在冷水中溶解度较小,为了降低其溶解度并充分析出乙酰水杨酸固体(结晶),所以①中需使用冷水,故答案为:充分析出乙酰水杨酸固体(结晶);
(4)碳酸氢钠能和难溶性的乙酰水杨酸反应生成可溶性的乙酰水杨酸钠,从而分离难溶性杂质,达到分离提纯目的,故答案为:生成可溶的乙酰水杨酸钠;
(5)固体经纯化方法为重结晶,所以④采用的纯化方法为重结晶,故答案为:重结晶;
(6)醋酸酐质量=10mL×1.10g/mL=11g,6.9g水杨酸完全反应消耗醋酸酐质量=![]() =5.1g<11g,所以醋酸酐有剩余,则理论上生成乙酰水杨酸质量=
=5.1g<11g,所以醋酸酐有剩余,则理论上生成乙酰水杨酸质量=![]() =9g,产率=
=9g,产率=![]() =60%,故答案为:60。
=60%,故答案为:60。


科目:高中化学 来源: 题型:
【题目】为探究原电池和电解池的工作原理,某研究性小组分别用如图所示装置进行实验。
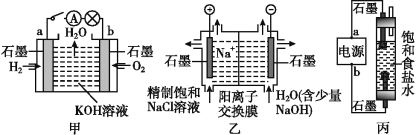
(1)甲装置中,a电极的反应式为_______________________________________。
(2)乙装置中,阴极区产物为________和_______。
(3)丙装置是一种家用环保型消毒液发生器。外接电源a为_______(填“正”或“负”)极,该装置内,发生的电解方程式为___________________________________、生成消毒液的方程式为________________________________________________________。
(4)若甲装置作为乙装置的电源,一段时间后,甲中消耗气体与乙中产生气体的物质的量之比为___________(不考虑气体的溶解)。
(5)某工厂采用电解法处理含Cr2O72-的废水,耐酸电解槽用铁板作阴、阳极,槽内盛放含铬废水,Cr2O72-被还原成为Cr3+,Cr3+在阴极区生成Cr(OH)3沉淀除去,工作原理如图:
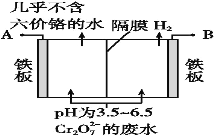
①写出电解时阳极的电极反应式:______________________________________。
②写出Cr2O72-被还原为Cr3+的离子方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各实验装置图的叙述中正确的是
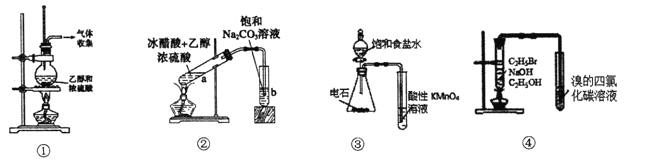
A. 装置①:实验室制取乙烯
B. 装置②:实验室制取乙酸乙酯
C. 装置③:验证乙炔的还原性
D. 装置④:验证溴乙烷发生消去反应可生成烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)
(1)向一定物质的量浓度的Cu(NO3)2 和Mn(NO3)2 溶液中加入Na2CO3 溶液,所得沉淀经高温灼烧,可制得CuMn2O4,NO3﹣的空间构型是______________________(用文字描述).
(2)在铜锰氧化物的催化下,CO 被氧化为CO2,HCHO 被氧化为CO2 和H2O.
①根据等电子体原理,CO 分子的结构式为____________.
②H2O 分子中O 原子轨道的杂化类型为____________.
③1mol CO2 中含有的σ键数目为__________________.
(3)H2SeO3的K1和K2分别为2.7×10﹣3和2.5×10﹣8,H2SeO4第一步几乎完全电离,K2为1.2×10﹣2,请根据结构与性质的关系解释:H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:_______________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质都属于醇类,但不是同系物的是( )
A.C2H5OH和CH3—O—CH3
B.![]() 和
和![]()
C.CH3CH2OH和CH2=CHCH2OH
D.CH2OHCH2OH和CH3CHOHCH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生产生活中用途广泛,利用FeSO4制备还原铁粉的工业流程如下:
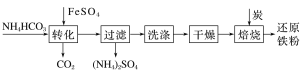
实验室中可用FeSO4(用铁粉和稀硫酸反应制得)和NH4HCO3在如下装置模拟上述流程中的“转化”环节。
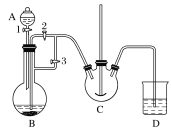
(1)装置A的名称是________,装置B中盛放的药品是________,NH4HCO3盛放在装置________中。
(2)实验过程中,欲将生成的FeSO4溶液和NH4HCO3溶液混合,操作方法是______________,
发生主要反应的离子方程式为_________。FeSO4溶液要现用现配制的原因是_______,检验久置的FeSO4是否变质的方法是_________________。
(3)干燥过程的主要目的是脱去游离水,该过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为________,取干燥后的FeCO3样品12.49 g,与炭混合后焙烧,最终得到还原铁粉6.16 g,计算样品中杂质FeOOH的质量:________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机高分子化合物或材料的说法不正确的是( )
A.能发生缩聚反应的单体至少含有2种官能团
B.未经过处理的天然橡胶性质不稳定,在空气、日光作用下会发生老化
C.导电塑料是应用于电子工业的一种新型有机高分子材料
D.棉花属于天然纤维,尼龙属于合成纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向碳酸溶液中滴加NaOH溶液,测得碳酸中含碳微粒的物质的量分数随pH变化如下图所示,下列说法不正确的是
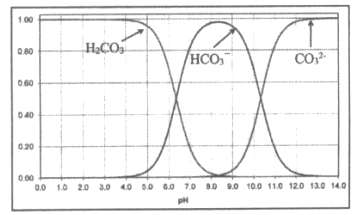
A.人体血液的pH=7.35~7.45,其中含碳微粒以HCO3-、H2CO3为主
B.除去NaCl溶液中Na2CO3的方法是向其中加入盐酸至pH=7
C.pH=10的溶液中c(H+)+c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.将CO2通入NaOH溶液制取Na2CO3,应大约控制pH>12.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用标准![]() 溶液来测定未知浓度的盐酸的浓度:
溶液来测定未知浓度的盐酸的浓度:
(1)配制250mL 0.5mol/L的![]() 溶液所需的玻璃仪器为________________________。
溶液所需的玻璃仪器为________________________。
(2)用滴定管准确量取20.00mL未知浓度的盐酸于锥形瓶中,加入酚酞作指示剂,用![]() 溶液滴定到终点。
溶液滴定到终点。
该同学进行了三次实验,实验数据如下表:
实验编号 | 盐酸的体积(mL) | 标准 |
1 | 20.00 | 18.20 |
2 | 17.10 | |
3 | 16.90 |
滴定中误差较大的是第______次实验,造成这种误差的可能原因是______(填选项编号)
a、在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干
b、滴定管在盛装标准![]() 溶液前未润洗
溶液前未润洗
c、滴定开始前盛装标准![]() 溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
d、滴定开始前盛装标准![]() 溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
e、滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
f、达到滴定终点时,俯视溶液凹液面最低点读数
g、滴定到终点时,溶液颜色由无色变到了红色
(3)该同学所测得盐酸的物质的量浓度为______________________(结果保留三位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com