
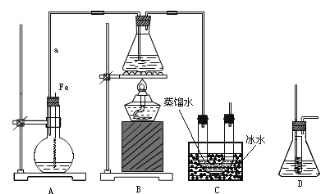
°ĺŐ‚ńŅ°ŅŐķľį∆šĽĮļŌőÔ‘ŕ»’≥£…ķ≤ķ…ķĽÓ÷–”√ÕĺĻ„∑ļ£¨ņŻ”√FeSO4÷∆ĪłĽĻ‘≠Őķ∑ŘĶńĻ§“ĶŃų≥Ő»ÁŌ¬£ļ
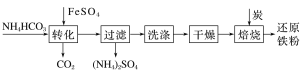
Ķ—ť “÷–Ņ…”√FeSO4£®”√Őķ∑ŘļÕŌ°ŃÚňŠ∑ī”¶÷∆Ķ√£©ļÕNH4HCO3‘ŕ»ÁŌ¬◊į÷√ń£ń‚…Ō ŲŃų≥Ő÷–Ķń°į◊™ĽĮ°ĪĽ∑Ĺŕ°£
£®1£©◊į÷√AĶń√Ż≥∆ «________£¨◊į÷√B÷– Ę∑ŇĶń“©∆∑ «________£¨NH4HCO3 Ę∑Ň‘ŕ◊į÷√________÷–°£
£®2£© Ķ—ťĻż≥Ő÷–£¨”ŻĹę…ķ≥…ĶńFeSO4»‹“ļļÕNH4HCO3»‹“ļĽžļŌ£¨≤Ŕ◊ų∑Ĺ∑® «______________£¨
∑Ę…ķ÷ų“™∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺő™_________°£FeSO4»‹“ļ“™Ō÷”√Ō÷Ňš÷∆Ķń‘≠“Ú «_______£¨ľž—ťĺ√÷√ĶńFeSO4 «∑ŮĪš÷ Ķń∑Ĺ∑® «_________________°£
£®3£©ł…‘ÔĻż≥ŐĶń÷ų“™ńŅĶń «Õ—»•”őņŽňģ£¨ł√Ļż≥Ő÷–ĽŠ”–…ŔŃŅFeCO3‘ŕŅ’∆Ý÷–ĪĽ—űĽĮő™FeOOH£¨ł√∑ī”¶ĶńĽĮ—ß∑Ĺ≥Ő Ĺő™________£¨»°ł…‘ÔļůĶńFeCO3—ý∆∑12.49 g£¨”ŽŐŅĽžļŌļůĪļ…’£¨◊Ó÷’Ķ√ĶĹĽĻ‘≠Őķ∑Ř6.16 g£¨ľ∆ň„—ý∆∑÷–‘”÷ FeOOHĶń÷ ŃŅ£ļ________ g°£
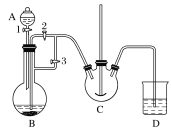
°ĺīūįł°Ņ∑÷“ļ¬©∂∑ Őķ∑Ř C £®īżDī¶Ķń«‚∆ÝīŅĺĽļů£©ĻōĪ’ĽÓ»Ż3£¨īÚŅ™ĽÓ»Ż2 Fe2£ę£ę2 HCO3 =FeCO3°ż£ęCO2°Ł£ęH2O£®ĽÚFe2£ę£ęHCO3 =FeCO3°ż£ęH£ę°ĘHCO3£ęH£ę=CO2°Ł£ęH2O£© —«ŐķņŽ◊”“◊ĪĽ—űĽĮ »°—ý∆∑Ňš≥…»‹“ļ£¨»°…ŔŃŅ»‹“ļ”ŕ ‘Ļ‹÷–£¨‘ŔŌÚ ‘Ļ‹÷–ľ”»ŽKSCN»‹“ļ£¨ĻŘ≤ž «∑ŮŌ‘—™ļž…ę 4FeCO3£ęO2£ę2H2O=4FeOOH£ę4CO2 0.89
°ĺĹ‚őŲ°Ņ
łýĺ›◊į÷√Õľ£¨Ņ…÷™ĻōĪ’ĽÓ»Ż2°ĘīÚŅ™ĽÓ»Ż3£¨B÷–Őķ∑Ř”ŽŌ°ŃÚňŠ∑ī”¶…ķ≥…ŃÚňŠ—«ŐķļÕ«‚∆Ý£¨…ķ≥…Ķń«‚∆Ýį—C÷–Ņ’∆ÝŇŇ≥Ų£¨‘ŔĻōĪ’ĽÓ»Ż3°ĘīÚŅ™ĽÓ»Ż2£¨≤ķ…ķĶń«‚∆Ýį—ŃÚňŠ—«Őķ—Ļ»ŽC÷–”ŽŐľňŠ«‚Ôß∑ī”¶°£
łý囓‘…Ō∑÷őŲ£¨£®1£©◊į÷√A «∑÷“ļ¬©∂∑£¨ Ę∑ŇŌ°ŃÚňŠ£¨◊į÷√B÷– Ę∑ŇŐķ∑Ř£¨Ō°ŃÚňŠ”ŽŐķ∑Ř∑ī”¶…ķ≥…H2ļÕFeSO4°£◊į÷√C÷– Ę∑ŇNH4HCO3°£
£®2£©ľž—ťDī¶«‚∆Ý“—īŅĺĽ Ī£¨ĪŪ√ų◊į÷√÷–Ņ’∆Ý“—ŇŇĺ°£¨ĻōĪ’ĽÓ»Ż3£¨īÚŅ™ĽÓ»Ż2£¨‘ŕ«‚∆Ý◊ų”√Ō¬ĹęFeSO4»‹“ļ—Ļ»ŽC÷–∑Ę…ķ∑ī”¶°£ŐľňŠ«‚ÔßļÕŃÚňŠ—«Őķ ‘ŕC÷–∑ī”¶…ķ≥…ŐľňŠ—«Őķ£¨Õ¨ Ī∑Ň≥Ų∂Ģ—űĽĮŐľ£¨∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺ «Fe2£ę£ę2HCO3 =FeCO3°ż£ęCO2°Ł£ęH2O £ĽFeSO4ĺŖ”–ĽĻ‘≠–‘£¨“◊ĪĽO2—űĽĮ£¨Ļ FeSO4»‹“ļ“™Ō÷”√Ō÷Ňš°£»ŰFeSO4Īš÷ £¨‘Ú»‹“ļ÷–”–Fe3£ę…ķ≥…£¨Fe3£ę”ŲKSCN»‹“ļŌ‘ļž…ę£¨ňý“‘”√KSCN»‹“ļľž—ťĺ√÷√ĶńFeSO4 «∑ŮĪš÷ °£
£®3£©FeCO3°ĘH2O°ĘO2∑ī”¶…ķ≥…FeOOHļÕCO2£¨∑ī”¶∑Ĺ≥Ő Ĺ «4FeCO3£ęO2£ę2H2O=4FeOOH£ę4CO2°£…Ťł…‘ÔļůĶńFeCO3—ý∆∑÷–FeCO3°ĘFeOOHĶńőÔ÷ ĶńŃŅ∑÷Īūő™xmol°Ęymol£¨‘Úxmol°Ń116 g°§mol£≠1£ęymol°Ń89 g°§mol£≠1£Ĺ12.49g£¨56 g°§mol£≠1°Ń£®x£ęy£©£Ĺ6.16 g£¨Ĺ‚Ķ√£ļx£Ĺ0.1 mol£¨y£Ĺ0.01 mol°£Ļ m£®FeOOH£©£Ĺ0.89 g°£



| ńÍľ∂ | łŖ÷–Ņő≥Ő | ńÍľ∂ | ≥ű÷–Ņő≥Ő |
| łŖ“Ľ | łŖ“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű“Ľ | ≥ű“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ∂Ģ | łŖ∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű∂Ģ | ≥ű∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ»ż | łŖ»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű»ż | ≥ű»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° |
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ…ŤNAő™įĘ∑Łľ”Ķ¬¬ř≥£ żĶń÷Ķ£¨Ō¬Ń–ňĶ∑®’ż»∑Ķń «
A.∑ī”¶5NH4NO3£Ĺ2HNO3£ę4N2°Ł£ę9H2O£¨…ķ≥…22.4LN2 Ī◊™“∆ĶńĶÁ◊” żő™3.75NA
B.1 molŇ®ŃÚňŠ”Ž◊„ŃŅMgÕÍ»ę∑ī”¶£¨◊™“∆ĶÁ◊” żŅ…ń‹ő™NA
C.ĪÍ◊ľ◊īŅŲŌ¬ľ◊Õť£®CH4£©ļÕ—ű∆Ý£®—ű∆Ý≥š◊„£©ĶńĽžļŌ∆ÝŐŚĻ≤22.4L£¨Õͻ껾…’ļů≤ķőÔĶń∑÷◊”◊‹ ż“Ľ∂®ő™NA
D.10gĶńD2O÷–ļ¨”–Ķń÷ ◊” ż”Ž÷–◊” ż∑÷Īūő™5NAļÕ4NA
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅĹę2.56gCuļÕ“Ľ∂®ŃŅĶńŇ®HNO3∑ī”¶£¨ňś◊ŇCuĶń≤Ľ∂Ōľű…Ŕ£¨∑ī”¶…ķ≥…∆ÝŐŚĶń—’…ę÷ūĹ•Īš«≥£¨ĶĪCu∑ī”¶ÕÍĪŌ Ī£¨Ļ≤ ’ľĮĶĹ∆ÝŐŚ1.12L(ĪÍ◊ľ◊īŅŲ)£¨‘Ú∑ī”¶÷–ŌŻļńHNO3ĶńőÔ÷ ĶńŃŅő™( )
A.0.05molB.1molC.1.05molD.0.13mol
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņń≥Ļ§≥ßĶńĻ§“Ķ∑Ōňģ÷–ļ¨”–īůŃŅĶńAl2(SO4)3°ĘĹŌ∂ŗĶńCu2+ļÕ…ŔŃŅĶńNa+°£ī”Ļ§“Ķ∑Ōňģ÷–Ľō ’Ĺū ۬ŃļÕĹū ŰÕ≠ĶńĻ§“’Ńų≥Ő»ÁŌ¬Õľňý ĺ( ‘ľŃX°ĘY°ĘZĺýĻżŃŅ)°£
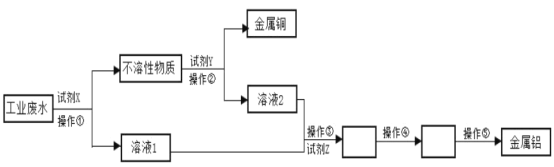
(1) ‘ľŃXő™_______£¨ľ”»Ž ‘ľŃX∑Ę…ķĶńņŽ◊”∑Ĺ≥Ő Ĺ «___________ ‘ľŃZő™___________°£
(2)≤Ŕ◊ųĘŕő™____________(ŐÓ Ķ—ť∑÷ņŽ∑Ĺ∑®)°£
(3)»‹“ļ2÷–ļ¨”–Ķń»‹÷ ”–__________(ŐÓĽĮ—ß Ĺ)°£
(4)–ī≥Ų≤Ŕ◊ųĘ‹ĶńĽĮ—ß∑ī”¶∑Ĺ≥Ő Ĺ____________°£
(5)Ĺū ŰÕ≠ń‹”ŽŇ®ŃÚňŠ‘ŕľ”»»ĶńŐűľĢŌ¬∑Ę…ķ∑ī”¶£¨≤ķ…ķĶń∆ÝŐŚő™_________(ŐÓĽĮ—ß Ĺ)°£
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
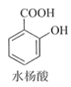
°ĺŐ‚ńŅ°Ņ““ű£ňģ—ÓňŠ£®įĘňĺ∆•Ń÷£© «ńŅ«į≥£”√“©őÔ÷ģ“Ľ°£ Ķ—ť “Õ®Ļżňģ—ÓňŠĹÝ––““ű£ĽĮ÷∆ĪłįĘňĺ∆•Ń÷Ķń“Ľ÷÷∑Ĺ∑®»ÁŌ¬£ļ
 +£®CH3CO£©2O£®ī◊ňŠŰŻ£©
+£®CH3CO£©2O£®ī◊ňŠŰŻ£©![]()
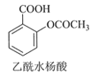 +CH3COOH
+CH3COOH
ňģ—ÓňŠ | ī◊ňŠŰŻ | ““ű£ňģ—ÓňŠ | |
»ŘĶ„/°ś | 157°ę159 | 72°ę 74 | 135°ę138 |
Ōŗ∂‘√‹∂»/£®g °§ cm3£© | 1.44 | 1.10 | 1.35 |
Ōŗ∂‘∑÷◊”÷ ŃŅ | 138 | 102 | 180 |
Ķ—ťĻż≥Ő£ļ‘ŕ100 mL◊∂–ő∆Ņ÷–ľ”»Žňģ—ÓňŠ6.9 gľįī◊ňŠŰŻ10 mL£¨≥š∑÷“°∂Į ĻĻŐŐŚÕͻ껋ł°£Ľļ¬żĶőľ”0.5 mLŇ®ŃÚňŠļůľ”»»£¨ő¨≥÷∆Ņńŕő¬∂»‘ŕ70 °ś◊ů”“£¨ ≥š∑÷∑ī”¶°£…‘ņšļůĹÝ––»ÁŌ¬≤Ŕ◊ų£ļ
ĘŔ‘ŕ≤Ľ∂ŌĹŃįŤŌ¬Ĺę∑ī”¶ļůĶńĽžļŌőÔĶĻ»Ž100 mLņšňģ÷–£¨őŲ≥ŲĻŐŐŚ£¨Ļż¬ň°£
ĘŕňýĶ√ĹŠĺßī÷∆∑ľ”»Ž50 mLĪ•ļÕŐľňŠ«‚ń∆»‹“ļ£¨»‹Ĺ‚°ĘĻż¬ň°£
Ęجň“ļ”√Ň®—őňŠňŠĽĮļůņš»ī°ĘĻż¬ňĶ√ĻŐŐŚ°£
Ę‹ĻŐŐŚĺ≠īŅĽĮĶ√į◊…ęĶń““ű£ňģ—ÓňŠĺßŐŚ5.4 g°£ĽōīūŌ¬Ń–ő Ő‚£ļ
£®1£©ł√ļŌ≥…∑ī”¶÷–”¶≤…”√_____ľ”»»°££®ŐÓĪÍļŇ£©
A »»ňģ‘° B ĺ∆ĺęĶ∆ C √ļ∆ÝĶ∆ D ĶÁ¬Į
£®2£©Ō¬Ń–≤£Ńß“«∆ų÷–£¨ĘŔ÷––Ť Ļ”√Ķń”–_____£®ŐÓĪÍļŇ£©°£
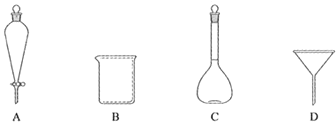
£®3£©ĘŔ÷––Ť Ļ”√ņšňģ£¨ńŅĶń «_____°£
£®4£©Ęŕ÷–Ī•ļÕŐľňŠ«‚ń∆Ķń◊ų”√ «_____£¨“‘Ī„Ļż¬ň≥ż»•ń—»‹‘”÷ °£
£®5£©Ę‹≤…”√ĶńīŅĽĮ∑Ĺ∑®ő™_____°£
£®6£©Īĺ Ķ—ťĶń≤ķ¬ «_____%°£
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ Ķ—ť “ņŻ”√Ō¬Õľňý ĺĶń◊į÷√÷∆Īłł…‘Ô°ĘīŅĺĽĶń¬»∆Ý°£Ō¬Ń–”–Ļō–ū Ų≤Ľ’ż»∑Ķń «£® £©
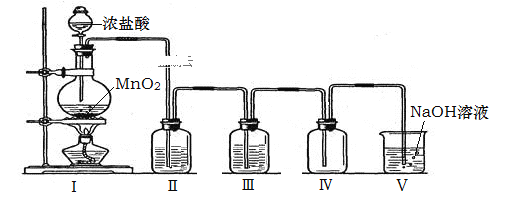
A.Īĺ Ķ—ť≤Ŕ◊ųň≥–Úő™£ļľž—ť◊į÷√∆Ý√‹–‘°ķŐŪľ”ĻŐŐŚ“©∆∑°ķŐŪľ”“ļŐŚ“©∆∑°ķľ”»»
B.◊į÷√ĘÚ°ĘĘů÷–Ķń ‘ľŃ“ņīőő™Ň®ŃÚňŠ°ĘĪ•ļÕNaCl»‹“ļ
C.¬»∆Ý√‹∂»Ī»Ņ’∆Ýīů£¨Ļ ◊į÷√ĘŰ÷–≥§ĶľĻ‹ĹÝ∆Ý£¨∂ŐĶľĻ‹≥Ų∆Ý
D.◊į÷√Ęű÷–∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺő™£ļCl2+2OH©Ā£ĹCl©Ā+ClO©Ā+ H2O
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬Õľ «Ķš–ÕőĘ…ķőÔ»ľŃŌĶÁ≥ō‘≠ņŪ ĺ“‚Õľ°£»Ű”√ļ¨ŌűňŠ—ő∑ŌňģŐśīķÕľ÷–—ű∆Ý£¨Ņ…īÔĶĹ∑Ōňģī¶ņŪĶńńŅĶń(“—÷™£ļa “÷–őĘ…ķőÔĹĶĹ‚”–ĽķőÔ≤ķ…ķe-°ĘCO2ļÕH+£©°£Ļō”ŕł√ĶÁ≥ō£¨Ō¬Ń–ňĶ∑®≤Ľ’ż»∑Ķń «
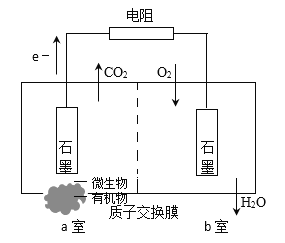
A.H+Õ®Ļż÷ ◊”ĹĽĽĽń§ī”a “ĹÝ»Žb “
B.a “ńŕ∑Ę…ķ—űĽĮ∑ī”¶£¨ĶÁľęő™’żľę
C.b “ńŕ∑Ę…ķĶńĶÁľę∑ī”¶ő™£ļO2+4e-+4H+=2H2O
D.ĹęŌűňŠ—ő◊™ĽĮő™N2 Ī£¨ĶÁľę∑ī”¶ő™£ļ2NO3-+10e-+12H+=N2+6H2O
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņń≥—–ĺŅ–‘—ßŌį–°◊ťĶńÕ¨—ß…Ťľ∆Ńň»ÁÕľ◊į÷√÷∆»°šŚĪĹļÕšŚ““Õť£ļ
“—÷™£ļ““īľ‘ŕľ”»»ĶńŐűľĢŌ¬Ņ…”ŽHBr∑ī”¶Ķ√ĶĹšŚ““Õť£®CH3CH2Br£©£¨∂Ģ’Ŗń≥–©őÔņŪ–‘÷ »ÁŌ¬ ĪŪňý ĺ£ļ
»‹Ĺ‚–‘£®Īĺ…ŪĺýŅ…◊ų»‹ľŃ£© | ∑–Ķ„£®°ś£© | √‹∂»£®g/mL£© | |
““īľ | ”ŽňģĽ•»‹£¨“◊»‹”ŕ”–Ľķ»‹ľŃ | 78.5 | 0.8 |
šŚ““Õť | ń—»‹”ŕňģ£¨“◊»‹”ŕ”–Ľķ»‹ľŃ | 38.4 | 1.4 |
«ŽĽōīūŌ¬Ń–ő Ő‚£ļ
£®1£©B÷–∑Ę…ķ∑ī”¶…ķ≥…ńŅĪÍ≤ķőÔĶńĽĮ—ß∑Ĺ≥Ő Ĺő™______°£
£®2£©ĶľĻ‹aĶń◊ų”√ «______°£
£®3£©∑ī”¶ÕÍĪŌļů£¨U–őĻ‹ńŕĶńŌ÷Ōů «______£Ľ∑÷ņŽšŚ““Õť Īňý–ŤĶń≤£Ńß“«∆ų «______°£
£®4£©ľÚ Ų Ķ—ť÷–”√īŅŐķňŅīķŐśŐķ∑ŘĶń”ŇĶ„£ļ______°£
£®5£© Ķ—ťÕÍ≥…ļů£¨ń≥Õ¨—ß‘ŕšŚ““Õť÷–ľ”»ŽNaOH““īľ»‹“ļ≤Ęľ”»»£¨ő™Ň–∂Ō∆š∑Ę…ķĶń «ňģĹ‚ ∑ī”¶ĽĻ «ŌŻ»•∑ī”¶£¨ł√Õ¨—ß…Ťľ∆Ńňľ◊°Ę““ŃĹłŲ∑Ĺįł£ļ
∑Ĺįłľ◊£ļŌÚ∑ī”¶ĽžļŌ“ļ÷–Ķő»ŽšŚňģ£¨»Ű»‹“ļ—’…ęļ‹ŅžÕ »•£¨‘ÚŅ…÷§√ų∑Ę…ķŃňŌŻ»•∑ī”¶
∑Ĺįł““£ļŌÚ∑ī”¶ĽžļŌ“ļ÷–Ķő»ŽňŠ–‘KMnO4»‹“ļ£¨»Ű»‹“ļ—’…ęĪš«≥£¨‘Ú÷§√ų∑Ę…ķŃňŌŻ»•∑ī”¶°£
‘Ú”–Ļō…Ō Ų Ķ—ť∑ĹįłĶń–ū Ų£®_____£©
A ∑Ĺįłľ◊’ż»∑ B ∑Ĺįł““’ż»∑ C ŃĹłŲ∑Ĺįł∂ľ≤Ľ’ż»∑
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ”–őÔ÷ ĶńŃŅŇ®∂»ĺýő™0.1molL-1ĶńĘŔNH4Cl»‹“ļ£¨ĘŕNaCl»‹“ļ£¨ĘŘHCl»‹“ļłų20mL£¨Ō¬Ń–ňĶ∑®īŪőůĶń «£® £©
A.»ż÷÷»‹“ļ÷–c(Cl-)ĶńĻōŌĶ «ĘŔ=Ęŕ=ĘŘ
B.»ŰĹ껿÷÷»‹“ļŌ° ÕŌŗÕ¨ĶńĪ∂ ż£¨pHĪšĽĮ◊Ó–°Ķń «Ęŕ
C.»ż÷÷»‹“ļ÷–”…ňģĶÁņŽ≥ŲĶńc(H+)ĶńĻōŌĶ «ĘŔ<Ęŕ<ĘŘ
D.»ŰŌÚ»ż÷÷»‹“ļ÷–∑÷Īūľ”»Ž20mL0.1molL-1ĶńNaOH»‹“ļļů£¨pH◊Ó–°Ķń «ĘŘ
≤ťŅīīūįłļÕĹ‚őŲ>>
Ļķľ —ß–£”Ň—° - Ń∑Ōį≤ŠŃ–ĪŪ - ‘Ő‚Ń–ĪŪ
ļĢĪĪ °Ľ•Ń™ÕÝő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®∆ĹŐ® | ÕÝ…Ō”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | ĶÁ–Ň’©∆≠ĺŔĪ®◊®«Ý | …śņķ ∑–ťőř÷ų“Ś”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | …ś∆ů«÷»®ĺŔĪ®◊®«Ý
ő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®ĶÁĽį£ļ027-86699610 ĺŔĪ®” Ōš£ļ58377363@163.com