
 2H2O,反应前后不发生变化的是
2H2O,反应前后不发生变化的是科目:高中化学 来源: 题型:阅读理解
氨有着广泛的用途,如可用于化肥、硝酸、合成纤维等工业生产。氨的水溶液中存在电离平衡,常用电离常数Kb和电离度α来定量表示其电离程度。Kb和α常用的测定方法:在一定温度时用酸度计测定一系列已知浓度氨水的pH,可得各浓度氨水对应的c(OH-),然后通过换算求得各对应的α值和Kb值。下面是某中学化学兴趣小组在25℃时测定一系列浓度氨水的pH所对应的c(OH-):
【仪器与试剂】酸度计、50 mL碱式滴定管、100mL烧杯、 0.10 mol·L-1 氨水
【实验数据】(不必填表格)
| 烧杯号 | V氨水 (mL) | V水(mL) | c (NH3·H2O) (mol·L-1) | c(OH-) | Kb | α |
| 1 | 50.00 | 0.00 |
| 1.34×10-3 |
|
|
| 2 | 25.00 | 25.00 |
| 9.48×10-4 |
|
|
| 3 | 5.00 | 45.00 |
| 4.24×10-4 |
|
|
请根据以上信息回答下述问题:
(1)25℃时,氨水的电离常数:Kb![]() ▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。
▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。
(2)用0.10mol·L—1盐酸分别滴定20.00mL0.10mol·L—1的NaOH溶液和20.00mL0.10mol·L—1
氨水所得的滴定曲线如下:
请指出盐酸滴定氨水的曲线为 ▲ (填A或B),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序 ▲ 。
(3)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧试验机中相关的反应有:
4NH3(g)+3O2(g)= 2N2(g)+6H2O(l) △H1 ①
4NH3(g)+5O2(g)= 4NO(g)+6H2O(l) △H2 ②
4NH3(g)+6NO(g)= 5N2(g)+6H2O(l) △H3 ③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= ▲ 。
(4)Allis-Chalmers制造公司发现可以用氨作为燃料电池的燃料。其总反应式为4NH3+3O2=2N2+6H2O,正极上的电极反应式为O2+2H2O+4e—=4OH—,则负极上的电极反应式为 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2011届浙江省台州市高三调考试题(理综)化学部分 题型:填空题
氨有着广泛的用途,如可用于化肥、硝酸、合成纤维等工业生产。氨的水溶液中存在电离平衡,常用电离常数Kb和电离度α来定量表示其电离程度。Kb和α常用的测定方法:在一定温度时用酸度计测定一系列已知浓度氨水的pH,可得各浓度氨水对应的c(OH-),然后通过换算求得各对应的α值和Kb值。下面是某中学化学兴趣小组在25℃时测定一系列浓度氨水的pH所对应的c(OH-):
【仪器与试剂】酸度计、50 mL碱式滴定管、100mL烧杯、 0.10 mol·L-1氨水
【实验数据】(不必填表格)
| 烧杯号 | V氨水 (mL) | V水(mL) | c (NH3·H2O)(mol·L-1) | c(OH-) | Kb | α |
| 1 | 50.00 | 0.00 | | 1.34×10-3 | | |
| 2 | 25.00 | 25.00 | | 9.48×10-4 | | |
| 3 | 5.00 | 45.00 | | 4.24×10-4 | | |
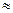 ▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。
▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。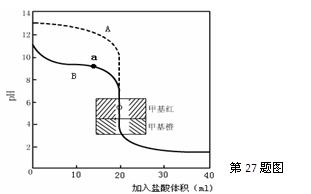
查看答案和解析>>
科目:高中化学 来源:2015届四川省高一上学期入学考试化学试卷(解析版) 题型:探究题
(10分)请你参与下列探究:
[问题情景]某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出。同学们都能解释红色固体物质的出现,请你写出生成红色固体物质的化学反应方程式 。但却对气体的生成产生了疑问,这激发了同学们强烈的探究欲望,生成的是什么气体?
[提出猜想]从物质组成元素的角度,放出的气体可能是O2、SO2、H2。
[查阅资料]SO2易溶于水,它能与过量的NaOH溶液反应,生成Na2SO3。
[方案设计]依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则较简单的检验方法是 。
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量。写出SO2与过量的NaOH溶液反应的化学方程式 。
(3)甲、乙同学实验的结果表明气体中既不含O2也不含SO2。丙同学根据以上实验结果推测气体是H2。
[实验探究]丙同学为了检验H2,收集了一试管气体,用拇指堵住试管口且管口略向下倾斜靠近火焰移开拇指点火,听到很小的声音。然后再将气体用带尖嘴的导管导出点燃且用冷而干燥的烧杯罩在火焰上方,气体在空气中安静的燃烧,产生淡蓝色火焰,烧杯壁上有水珠生成,接触烧杯的手能感觉到发热。
结论:铁粉与硫酸铜的溶液反应时,产生的气体是 。
[思维拓展]由上述实验可以推出,硫酸铜溶液中可能含有 物质。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省台州市高三调考试题(理综)化学部分 题型:填空题
氨有着广泛的用途,如可用于化肥、硝酸、合成纤维等工业生产。氨的水溶液中存在电离平衡,常用电离常数Kb和电离度α来定量表示其电离程度。Kb和α常用的测定方法:在一定温度时用酸度计测定一系列已知浓度氨水的pH,可得各浓度氨水对应的c(OH-),然后通过换算求得各对应的α值和Kb值。下面是某中学化学兴趣小组在25℃时测定一系列浓度氨水的pH所对应的c(OH-):
【仪器与试剂】酸度计、50 mL碱式滴定管、100mL烧杯、 0.10 mol·L-1 氨水
【实验数据】(不必填表格)
|
烧杯号 |
V氨水 (mL) |
V水(mL) |
c (NH3·H2O) (mol·L-1) |
c(OH-) |
Kb |
α |
|
1 |
50.00 |
0.00 |
|
1.34×10-3 |
|
|
|
2 |
25.00 |
25.00 |
|
9.48×10-4 |
|
|
|
3 |
5.00 |
45.00 |
|
4.24×10-4 |
|
|
请根据以上信息回答下述问题:
(1)25℃时,氨水的电离常数:Kb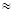 ▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系
▲ 。
▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系
▲ 。
(2)用0.10mol·L—1盐酸分别滴定20.00mL0.10mol·L—1的NaOH溶液和20.00mL0.10mol·L—1
氨水所得的滴定曲线如下:
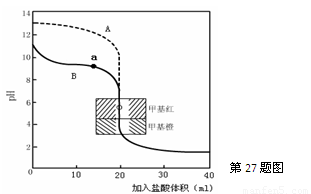
请指出盐酸滴定氨水的曲线为 ▲ (填A或B),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序 ▲ 。
(3)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧试验机中相关的反应有:
4NH3(g)+3O2(g)= 2N2(g)+6H2O(l) △H1 ①
4NH3(g)+5O2(g)= 4NO(g)+6H2O(l) △H2 ②
4NH3(g)+6NO(g)= 5N2(g)+6H2O(l) △H3 ③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= ▲ 。
(4)Allis-Chalmers制造公司发现可以用氨作为燃料电池的燃料。其总反应式为4NH3+3O2= 2N2+6H2O,正极上的电极反应式为O2+2H2O+4e—=4OH—,则负极上的电极反应式为 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com