
【题目】下列叙述正确的是
A. 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色
B. 有机物![]() 的消去产物只有2种
的消去产物只有2种
C. 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CH-COOCH3
D. 可用溴水鉴别已烯、四氯化碳和乙酸
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+===Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+===Cu+2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应至中性2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和碘单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
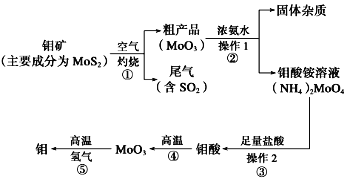
(1)写出在高温下发生反应①的化学方程式______________________________________________
(2)生产中用足量的浓氨水吸收反应①的尾气合成肥料,写出该反应的离子方程式:________________________________
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有_______________________
(4)某同学利用下图所示装置来制备氢气,利用氢气还原三氧化钼,根据要求回答问题:
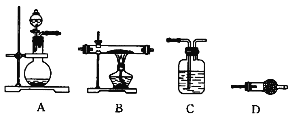
① 请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是___________
② 在烧瓶A中加入少量硫酸铜的目的是____________________________
③ 两次使用D装置,其中所盛的药品依次是____________________、______________________
(5)工业上制备还原性气体CO和H2的反应原理为CO2 + CH4![]() 2CO + 2H2 CH4 + H2O
2CO + 2H2 CH4 + H2O![]() CO + 3H2,含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为________________ (保留两位小数,钼的相对原子质量为96)
CO + 3H2,含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为________________ (保留两位小数,钼的相对原子质量为96)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5流程:
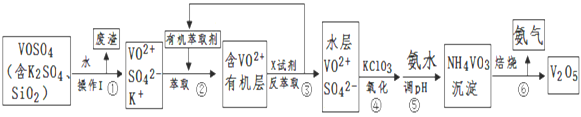
(1)步骤①所得废渣的成分是____________(写化学式),操作I的名称__________;
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n (水层)+ 2nHA(有机层)![]() 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是_____________________________;
③中X试剂为(写化学式)______________________________________;
(3)④的离子方程式为 ___________________________________________;
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为____________;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< _____________;(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有__________和_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.汽车尾气中含有NO、CO等有害物质,其中NOx会引起光化学烟雾等环境问题。
NH3-SCR技术是去除NOx最为有效的技术之一:在催化剂条件下,以NH3或尿素将尾气中NOx还原为N2从而降低污染。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因 _________________(用化学方程式表示,该反应为为可逆反应);汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因 _____________________________。
(2)①NH3去除尾气中的NOx,当v(NO):v(NO2)=1:1时称为“快速SCR 反应”,该反应化学方程式为______________________________________ ;
②合成NH3所用原料气H2,可用天然气为原料制得,有关反应能量变化如下所示。
CO(g)+![]() O2 (g)== CO2 (g) △H1=-282.0 KJ/mol
O2 (g)== CO2 (g) △H1=-282.0 KJ/mol
H2(g)+![]() O2 (g)=== H2O (g) △H2=-241.8 KJ/mol
O2 (g)=== H2O (g) △H2=-241.8 KJ/mol
CH4(g)+ 2O2 (g)== CO2 (g)+ 2H2O (g) △H3=-836.3 KJ/mol
则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为___________。
(3)通过NOx传感器可监测NOx的含量,其工作原理如图所示,则:
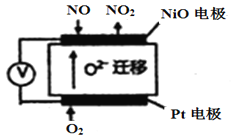
①Pt电极上发生的是 ______________反应(填“氧化”或“还原”);
②NiO电极上的电极反应式为______________________________________;
(4)研究发现,将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:2NO(g)+2CO(g)=N2(g)+2CO2(g)。在一定温度下,于2L的恒容密闭容器中充入0.1molNO和0.3molCO发生该反应,测得不同时间容器内的压强(p)与起始压强(p0)的比值(p/p0)如下表。
时间/t | 0min | 2min | 5min | 10min | 13min | 15min |
比值(p/p0) | 1 | 0.97 | 0.925 | 0.90 | 0.90 | 0.90 |
0~5min内,该反应的平均反应速率V(NO)=___________________;
(5)将上述反应的CO2与NH3为原料合成尿素,能够实现节能减排:①2NH3(g)+CO2(g)=NH2CO2NH4span>(s);②NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
对于上述反应②在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时P[H2O(g)]为aPa,若反应温度不变,将体系的体积增加50%,至达新平衡的过程中P[H2O(g)]的取值范围是__________________ (用含a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机反应中间体(M)的一种合成路线如图所示。



③标准状况下,气态烃A的密度是H2的14倍
④芳香族化合物H能发生银镜反应
请回答下列问题:
(1)B的名称(系统命名)为_____________ ;H→I的反应类型为___________;
(2)J中官能团的名称为_________,
(3)G→H的化学方程式为____________________________________________;
(4)D+J→M的化学方程式为__________________________________________;
(5)写出符合下列条件的J的所有同分异构体的结构简式________(不考虑立体异构)。
①苯环上连有-NO2 ②核磁共振氢谱有3个峰
符合以上条件的J的所有同分异构体在下列某种表征仪器中显示的信号(或数据)完全相同,该仪器是__________________(填选项字母)。
a.质谱仪 b.红外光谱仪 c.元素分析仪
(6)结合已有知识和相关信息,写出以CH3CHO和E为原料,经三步制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例为:
的合成路线流程图(无机试剂任用)。合成路线流程图示例为: _____________
_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年世界地球日宣传主题为“珍爱美丽地球 守护自然资源”。下列做法不符合这一主题的是
A. 超量开采稀土资源,满足全球市场供应
B. 推广清洁能源汽车,构建绿色交通体系
C. 合理处理废旧电池,进行资源化再利用
D. 科学施用化肥农药,避免大气和水污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向18.4 g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成NO2、NO混合气体,再向所得溶液中加入足量的NaOH溶液,生成30.3 g沉淀。另取等质量的合金,使其与一定量的Cl2恰好完全反应,则Cl2 的体积在标准状况下为
A. 4.48L B. 6.72L C. 7.84L D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-—选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com