
【题目】2019年世界地球日宣传主题为“珍爱美丽地球 守护自然资源”。下列做法不符合这一主题的是
A. 超量开采稀土资源,满足全球市场供应
B. 推广清洁能源汽车,构建绿色交通体系
C. 合理处理废旧电池,进行资源化再利用
D. 科学施用化肥农药,避免大气和水污染
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)①已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=196.6 kJ·mol–1
2SO3(g) ΔH=196.6 kJ·mol–1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=113.0 kJ·mol–1
2NO2(g) ΔH=113.0 kJ·mol–1
请写出NO2与SO2反应生成SO3(g)和NO的热化学方程式 。
②一定条件下,将NO2与SO2以体积比1:2置于2L密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO2的同时生成1 molNO2
(2)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO ( g ) + 2H2 ( g ) ![]() CH3OH ( g ) △H=-116kJ/mol
CH3OH ( g ) △H=-116kJ/mol
一定条件下在2L密闭容器中,将1 mol CO与3 mol H2的混合气体在催化剂作用下发生反应生成甲醇。
① 2min时测得生成CH3OH 0.2mol,则0~2min的平均反应速率v(H2)= 。
②反应5min后达到平衡,若平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
a.c(H2)减少
b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加
d.重新平衡c(H2)/c(CH3OH)减小
(3)在密闭容器中充有1mol CO与2 mol H2,在催化剂作用下反应生成甲醇,CO的转化率(α)与温度(T)、压强(P) 的关系如图所示。
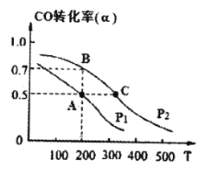
A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“>”、“<”或“=”)。
② 若A点时容器的体积为1 L,则该温度下B的平衡常数 KB= ,C点的平衡常数KC KB(填“<”、“>”或“=”)。
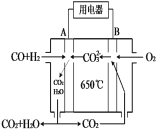
(4)下图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3共熔混合物为电解质。A为电池的 极(选填“正”或“负”),写出B极电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是
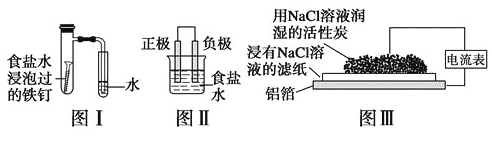
A. 按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B. 图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C. 铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑
D. 图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色
B. 有机物![]() 的消去产物只有2种
的消去产物只有2种
C. 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CH-COOCH3
D. 可用溴水鉴别已烯、四氯化碳和乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的3p能级上有两个未成对电子,因此其 ( )
A. 第三电子层上有4个电子B. 最高正价为+2
C. 最高正价为+4D. 第二电子层没有未成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组所做实验的示意图如图所示:图中“→”表示气体流向, M是一种纯净而干燥的气体,Y为另一种气体,E内有红棕色气体产生,实验所用物质只能由下列物质中选取:Na2CO3、Na2O2、NaCl、Na2O、CaCl2、(NH4)2CO3、碱石灰等固体及蒸馏水。据此实验,完成下列填空:
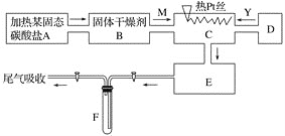
(1)A中所用装置的主要仪器和药品是______________________。
(2)B中所选的干燥剂是________,其作用是______________________________。
(3)C中发生的主要反应的化学方程式:________________________________。
(4)制取Y气体的D装置所用的主要仪器是__________________________。
制取Y气体的化学方程式是________________________。
(5)F中发生反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。

回答下列问题:
(1)反应的△H_______0(填“大于”或“小于”) ;100℃时,体系中各物质浓度随时间变化如上图所示。在0-60s时段,反应速率v(N2O4)为______mol·L-1·s-1;反应的平衡常数K1为________。
(2) 100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。
a: T______100℃ (填“大于”或“小于”) ,判断理是_______
b:计算温度T时反应的平衡常数K2(要求写出计算过程)__________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向______(填“正反应”或“逆反应”)方向移动,判断理由是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.氢氧化铝可用于中和过多胃酸
B.赏心悦目的雕花玻璃可用HF刻蚀而成
C.空气质量报告中有可吸入颗粒、SO2、NO2、CO2
D.光化学烟雾的形成与氮氧化物有关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com