
 2NH3(g) ��H��-92.4 kJ/mol��ʵ������ʼ��ƽ��ʱ���й��������±�������������ȷ����
2NH3(g) ��H��-92.4 kJ/mol��ʵ������ʼ��ƽ��ʱ���й��������±�������������ȷ����| ���� ��� | ��ʼʱ���������ʵ���/mol | ƽ��ʱ��Ӧ�е������仯 | ||
| N2 | H2 | NH3 | ||
| �� | 1 | 3 | 0 | �ų�����a kJ |
| �� | 2 | 3 | 0 | �ų�����b kJ |
| �� | 2 | 6 | 0 | �ų�����c kJ |


 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д� ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ���ữѧʽ | CH3COOH | HCN | H2CO3 |
| ����ƽ�ⳣ�� | 1.8��10-5 | 4.9��10-10 | K1=4.3��10-7 K2=5.6��10-11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2Z��g����H<0����ͼ��ʾ�ӷ�Ӧ��ʼ��t
2Z��g����H<0����ͼ��ʾ�ӷ�Ӧ��ʼ��t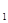 sʱ�ﵽƽ�⣬��t
sʱ�ﵽƽ�⣬��t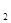 sʱ���������仯ʹƽ���ƻ�����t
sʱ���������仯ʹƽ���ƻ�����t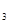 sʱ�ִ�ƽ�⡣����ͼ��t
sʱ�ִ�ƽ�⡣����ͼ��t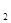 sʱ�ı������������
sʱ�ı������������
| A������ѹǿ |
| B��ʹ���˴��� |
| C�������¶� |
| D����С��X��Y��Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
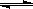 xC(g)��2minʱ��Ӧ����ƽ��״̬���¶Ȳ��䣩����ʱ������ʣ����0.8mol B,�����C��Ũ��Ϊ0.4mol��L-1������д���пհף�
xC(g)��2minʱ��Ӧ����ƽ��״̬���¶Ȳ��䣩����ʱ������ʣ����0.8mol B,�����C��Ũ��Ϊ0.4mol��L-1������д���пհף��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
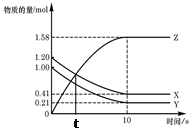
| A��t��ʱ�÷�Ӧ�ﵽ������Ũ�Ȳ���״̬ |
| B����Ӧ��ʼ��10 s��X�����ʵ���Ũ�ȼ�����0.79mol/L |
| C����Ӧ��ʼ��10sʱ��Y��ת����Ϊ21.0�� |
D����Ӧ�Ļ�ѧ����ʽΪ��X(g) + Y(g) 2Z(g) 2Z(g) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
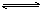 bB(g)��ƽ������¶Ȳ��䣬�����ﵽ�µ�ƽ��ʱ��B��Ũ����ԭ����60%����
bB(g)��ƽ������¶Ȳ��䣬�����ﵽ�µ�ƽ��ʱ��B��Ũ����ԭ����60%����| A��ƽ��������Ӧ�����ƶ��� | B������A��ת���ʼ����� |
| C������B���������������� | D��a > b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 N2(g)+2CO2(g)(����ӦΪ���ȷ�Ӧ)�������ô˷�Ӧ�������һ�ֻ���װ���Լ�������β���Դ�������Ⱦ��������Ʒ����������β������Ч������
N2(g)+2CO2(g)(����ӦΪ���ȷ�Ӧ)�������ô˷�Ӧ�������һ�ֻ���װ���Լ�������β���Դ�������Ⱦ��������Ʒ����������β������Ч������| A��������װ���й������ | B����߷�Ӧװ�õ��¶� |
| C�����ͷ�Ӧװ�õ�ѹǿ | D���ڷ�Ӧװ����װ���ʯ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 H2(g)��I2(g)����H��0����t1ʱ�ﵽƽ�⣬t2ʱ�������²����£���t3ʱ�ִﵽ��ƽ�⣬������һ�仯��ͼ����( )��
H2(g)��I2(g)����H��0����t1ʱ�ﵽƽ�⣬t2ʱ�������²����£���t3ʱ�ִﵽ��ƽ�⣬������һ�仯��ͼ����( )��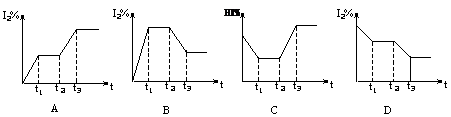
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Si(s)��4HCl(g)����H����Q kJ��mol��1��Q��0��
Si(s)��4HCl(g)����H����Q kJ��mol��1��Q��0��| A����Ӧ�����У�������ѹǿ��Ϊ��Ӧ�����������������SiCl4��ת���� |
B����֪��һ���¶��£���Ӧ��ƽ�ⳣ����k��Ϊ��ֵ�������Ѿ��ﵽƽ��״̬���������ٴμ����������ʣ���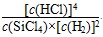 ��k��ƽ���Ҫ������Ӧ�����ƶ� ��k��ƽ���Ҫ������Ӧ�����ƶ� |
| C����Ӧ��4 minʱ����HCl��Ũ��Ϊ0.12 mol��L��1����H2�ķ�Ӧ����Ϊ0.03 mol/(L��min) |
| D������Ӧ��������Ϊ0.025Q kJʱ�����ɵ�HCl�ɱ�100 mL 1 mol��L��1��NaOH��Һǡ����ȫ���� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com