
【题目】某化学反应的反应物和产物如下:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
(1)该反应的氧化剂是
(2)如果该反应方程式中I2和KIO3的系数都是5 ①KMnO4的系数是
②在下面的化学式上标出电子转移的方向和数目KMnO4+KI+H2SO4→
(3)如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组.原因是 .
【答案】
(1)KMnO4
(2)8;![]()
(3)该反应式含两种氧化产物,两者的比例和氧化剂的用量都可发生变化.
【解析】解:(1)在氧化还原反应中,元素化合价的变化与发生反应的关系是:“升失氧,降得还,若说剂,正相反”.在KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O反应中,锰元素化合价由+7价降低为+2价,锰元素被还原,还原产物是MnSO4 , KMnO4是氧化剂,I元素的化合价由﹣1价升高为I2中的0价和KIO3中的+5价,KI作还原剂,发生氧化反应, 故答案为:KMnO4;
(1)根据元素的化合价的变化判断,反应物中元素的化合价降低的物质为氧化剂;(2)①根据氧化剂得到的电子总数等于还原剂失去的电子总数进行解答;②根据电子转移的表示方法,还原剂失去的电子总数指向氧化剂进行解答(3)该氧化还原反应的特点是两种氧化产物可能的配平系数有许多组,据此解答.(2)①在KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O反应中,KMnO4是氧化剂,KI作还原剂,I元素的化合价由﹣1价升高为I2中的0价和KIO3中的+5价,如果该反应方程式中I2和KIO3的系数都是5,则10KI~5I2 , 5KI~5KIO3 , 反应中碘元素失去的电子总数为【0﹣(﹣1)】×10+【+5﹣(﹣1)】×5=40,反应中,锰元素化合价由+7价降低为+2价,每一锰原子参加反应得5个电子,根据氧化剂得到的电子总数等于还原剂失去的电子总数,所以8KMnO4~8MnSO4 , 故答案为:8;②该反应方程式中I2和KIO3的系数都是5,则10KI~5I2 , 5KI~5KIO3 , 反应中碘元素失去的电子总数为【0﹣(﹣1)】×10+【+5﹣(﹣1)】×5=40,在氧化还原反应中,用单线桥表示电子转移的方法是,从还原剂中变化的元素出发指向氧化剂中变化的元素,因此该反应中电子转移的方向和数目可表示为 ![]() ,故答案为:
,故答案为: ![]() ;(3)在KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O反应中,KI作还原剂,I元素的化合价由﹣1价升高为I2中的0价和KIO3中的+5价,该反应式含两种氧化产物,两者的比例和氧化剂的用量都可发生变化,如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组,
;(3)在KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O反应中,KI作还原剂,I元素的化合价由﹣1价升高为I2中的0价和KIO3中的+5价,该反应式含两种氧化产物,两者的比例和氧化剂的用量都可发生变化,如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组,
故答案为:该反应式含两种氧化产物,两者的比例和氧化剂的用量都可发生变化.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如右图所示。据图判断正确的是
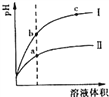
A. Ⅱ为盐酸稀释时的pH值变化曲线
B. b点溶液的导电性比c点溶液的导电性强
C. a点KW的数值比c点KW的数值大
D. b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时有三瓶溶液:pH=3的盐酸、pH=3的醋酸溶液和pH=11的氢氧化钠溶液,下列说法不正确的是
A. 分别用pH=11的氢氧化钠溶液中和等体积pH=3盐酸和pH=3醋酸溶液至pH=7,所需氢氧化钠溶液的体积前者小于后者
B. 等体积pH=3的盐酸和pH=3醋酸的溶液中分别加入少量相同的锌粒,醋酸中锌粒先反应完
C. 三瓶溶液加水稀释100倍,pH变化最大的是醋酸溶液
D. 三瓶溶液中水电离出的c(H+)均为1.0×10-11mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】属于加成反应的是
A. 乙烯使溴水褪色 B. 苯与硝酸反应生成硝基苯
C. 乙烯使酸性KMnO4溶液褪色 D. 甲烷与Cl2混合,光照后黄绿色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一份气体样品的质量是14.2 g,体积是4.48 L(标准状况下),该气体的摩尔质量是
A. 28.4 g B. 28.4 g·mol-1 C. 71 g·mol-1 D. 14.2 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学键和化合物的说法不正确的是
A.离子键就是阴阳离子间强烈的静电作用
B.H和Cl形成的分子中存在的是极性共价键
C.氯化铵中没有金属元素,所以不是离子化合物
D.11号与9号元素能够形成离子化合物,该化合物中存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既能与强酸反应,又能与强碱反应,且都能生成盐和水的是( )
①Al ②Al2O3 ③Al(OH)3 ④Na2CO3
A.①③B.②③④C.②③D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g) ![]() 2NO(g) △H1=+183 kJ·mol-1
2NO(g) △H1=+183 kJ·mol-1
2H2(g)+O2(g)=2H2O(1) △H2=-571. 6 kJ·mol-1
4NH3(g)+5O2(g) =4NO(g)+6H2O(1) △H3=-1164.4 kJ·mol-1
则合成氨的反应N2(g)+3H2(g)![]() 2NH3(g) △H=___________kJ·mol-1。
2NH3(g) △H=___________kJ·mol-1。
(2)在恒温恒容容积为a L的密闭容器中进行合成氨的反应,起始加入N2 1.0 molH23.0 mol。
①该温度下合成氨反应的平衡常数表达式为__________________;
②经过2min达到化学平衡状态时测得H2的转化率为40%,则平均化学反应速率v(NH3)__________;
③若其它条件不变增大压强,则合成氨反应的化学平衡常数____________(填“变大”、“变小或“不变”);
④L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2 (g)的平衡转化率随X的变化关系。

i .X代表的物理量是________________,
ii.判断L1、L2的大小关系____________ (填“>”“ <”或“ = ”),并简述理由:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a g钠、铝的混合物,放入b g水中,反应停止后得到的沉淀有c g,则溶液中溶质为( )
A. NaOH B. NaAlO2 C. NaOH和NaAlO2 D. 无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com