
【题目】三草酸合铁酸钾晶体{K3[Fe(C2O4)3]·3H2O}易溶于水,难溶于乙醇,可用于摄影和蓝色印刷。三草酸合铁酸钾晶体在110 ℃可完全失去结晶水,继续升高温度可发生分解反应。
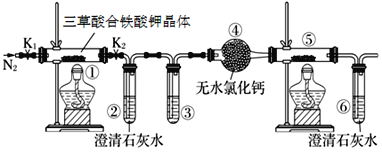
(1)分解得到的气体产物用如下装置进行实验:检查装置气密性后先通一段时间的N2,其目的是_____________;为了实验安全,应先点燃___________________(①或⑤)处的酒精灯;
(2)若③和⑤中分别盛放_____________ 、_______________就可检验生成的CO;
(3)分解得到的固体产物含有K2CO3、FeO、Fe,加水溶解、过滤、洗涤、干燥,得到含铁样品。现设计下列两种实验方案对该样品进行铁元素含量测定:
(甲)a g样品![]() 溶液
溶液![]()
![]() 得固体b g
得固体b g
(乙)a g样品![]() 配制250 mL溶液
配制250 mL溶液![]() ,三次平均消耗0.1 mol·L-1酸性KMnO4溶液V mL.
,三次平均消耗0.1 mol·L-1酸性KMnO4溶液V mL.
你认为以上________(填“甲”或“乙”)方案可确定样品的组成,测得铁元素的含量是__________,不可确定样品组成的方案的理由是____________。
【答案】排出装置内的空气 ①处酒精灯 足量NaOH溶液 CuO固体 甲 ![]() ×100% 乙方案中KMnO4能氧化Cl-,干扰结果
×100% 乙方案中KMnO4能氧化Cl-,干扰结果
【解析】
三草酸合铁(Ⅲ)酸钾晶体在110℃可完全失去结晶水,继续升高温度可发生分解反应,根据元素守恒推测得到的产物可能是K2CO3、FeO、Fe、CO2、CO,CO还原氧化铜,得到的金属铜可被氧气氧化,所以实验开始先通一段时间的N2,将装置中的空气排净,实验结束后为了防止倒吸,应该先熄灭酒精灯再通入N2至常温,实验过程中观察到②⑥中澄清石灰水变浑浊,即证明气体CO2产生,⑤红色固体生成,证明还原性气体CO生成,据此进行分析。
⑴检查装置气密性后先通一段时间的N2,其目的是将装置中的空气排净;为了实验安全,应先点燃①处酒精灯;故答案为:排除装置中的空气;①。
⑵若③中盛放足量的NaOH溶液除去分解产生的CO2,⑤中盛CuO与CO反应生成铜和CO2,实验过程中观察到⑤中红色固体生成,⑥中澄清石灰水变浑浊,即证明生成了气体CO2产生,证明还原性气体CO生成;故答案为:足量NaOH溶液;CuO固体。
⑶甲中样品溶解过程中亚铁离子被氧化生成铁离子,Fe3+和OH反应生成Fe(OH)3沉淀,灼烧该沉淀得到Fe2O3,根据铁原子守恒根据Fe原子守恒得![]() ,则样品中Fe元素质量分数
,则样品中Fe元素质量分数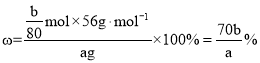 ;在实验方案乙中,先是用盐酸溶解,最后加入高锰酸钾后,高锰酸钾具有氧化性,能将亚铁离子以及氯离子氧化,这样会导致得到的亚铁离子的含量偏高,干扰实验结果,无法确定样品的组成;故答案为:甲;
;在实验方案乙中,先是用盐酸溶解,最后加入高锰酸钾后,高锰酸钾具有氧化性,能将亚铁离子以及氯离子氧化,这样会导致得到的亚铁离子的含量偏高,干扰实验结果,无法确定样品的组成;故答案为:甲;![]() ;乙方案中KMnO4能氧化亚铁离子以及氯离子,干扰结果。
;乙方案中KMnO4能氧化亚铁离子以及氯离子,干扰结果。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图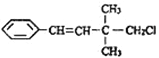 ,关于该有机物的下列叙述中不正确的是( )
,关于该有机物的下列叙述中不正确的是( )
A. 一定条件下,能发生加聚反应
B. 1mol该有机物在一定条件下最多能与4molH2发生反应
C. 能使酸性KMnO4溶液、溴水褪色,且原理相同
D. 该有机物苯环上的一溴代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用富锰渣(主要成分为MnCO3以及Fe、Ba及Al的盐类或氧化物及少量重金属盐等)制备MnCl2的工艺流程如下:

回答下列问题:
(1)“溶浸”时,为了提高锰的浸取率,列举2条有效的措施:___________,写出该步中MnCO3参与反应的化学方程式:__________。
(2)“氧化”时,主要反应的离子方程式为______________。
(3)滤渣2的主要成分为______(填化学式);简述产生该滤渣的原理:______。
(4)已知部分重金属硫化物的溶度积如表:
硫化物 | MnS | PbS | CuS | NiS |
Ksp | 1.32×10-10 | 1.32×10-27 | 1.32×10-35 | 2.82×10-20 |
①“除重金属”时,溶液的pH调到4.5~6.0,pH不宜过低的原因是_______。
②若表中四种金属离子浓度相同,滴入Na2S溶液时首先被沉淀的离子是_______,反应MnS(s)+Cu2+(aq)![]() CuS(s)+Mn2+(aq)的平衡常数K=______。
CuS(s)+Mn2+(aq)的平衡常数K=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现黑色和红色交替的现象,请写出相应的化学方程式______________________________、________________________________。
(2)甲水浴的作用是_________________________________________;乙水浴的作用是_________________________________________。
(3)反应进行一段时间后,干试管a中能收集到不同的物质,它们是________。集气瓶中收集到的气体的主要成分是________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有______。要除去该物质,可在混合液中加入____________(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1912年的诺贝尔化学奖授予法国化学家V.Grignard,用于表彰他所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成中的巨大贡献。Grignard试剂的合成方法是:RX+Mg ![]() RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)乙醚发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)乙醚发生反应,再水解就能合成各种指定结构的醇:

现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路如下:
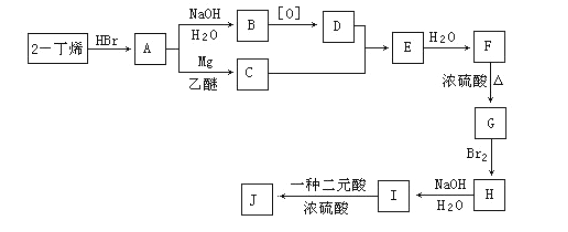
请按要求填空:
(1) 3,4-二甲基-3-己醇是: ____(填代号),E的结构简式是 ___;
(2)C→E的反应类型是 _____,H→I的反应类型是 ____;
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B ___ , I→J _____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
B. 在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液pH<7
C. 常温下,1.0×10—3mol/L盐酸的pH=3.0,1.0×10—8mol/L盐酸pH=8.0
D. 常温下,若1mLpH=1盐酸与100mLNaOH溶液混合后,溶液pH=7,则NaOH溶液的pH=11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

A. 图甲表示催化剂能改变化学反应的焓变
B. 图乙表示向氨水中加水时溶液导电性的变化情况,且溶液c(OH—)大小:a<b
C. 由图丙可知反应2A(g)+B(g) ![]() C(g)的△H >O,且a=2
C(g)的△H >O,且a=2
D. 图丁表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B![]() C(ΔH < 0)分两步进行:①A+B
C(ΔH < 0)分两步进行:①A+B![]() X(ΔH>0); ②X
X(ΔH>0); ②X![]() C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )。
C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )。
A.
B.
C.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态钛原子的价电子排布式为_____________,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有____________种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料,钛的硬度比铝大的原因是_________。
(3)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配合离子的化学式为___________。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如图所示。
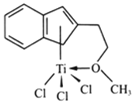
①组成M的元素中,电负性最大的是_________(填名称)。
②M中碳原子的杂化方式为____________。
③M中不含________(填代号)。
a.π键 b.σ键 c.离子键 d.配位键
(5)金红石(TiO2)是含钛的主要矿物之一。其晶胞结构(晶胞中相同位置的原子相同)如图所示。
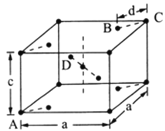
①A、B、C、D4种微粒,其中氧原子是________(填代号)。
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,____,___);钛氧键的键长d=______(用代数式表示)。
③若晶胞底边长为a cm,高为c cm,则TiO2晶体的密度为______g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com