
【题目】下列叙述正确的是( )
A. 某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
B. 在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液pH<7
C. 常温下,1.0×10—3mol/L盐酸的pH=3.0,1.0×10—8mol/L盐酸pH=8.0
D. 常温下,若1mLpH=1盐酸与100mLNaOH溶液混合后,溶液pH=7,则NaOH溶液的pH=11
【答案】D
【解析】
A.某醋酸溶液的pH=a,将此溶液稀释1倍后溶液中氢离子浓度减小,溶液的pH增大,则a<b,故A错误;
B.酚酞的变色范围为8~10,在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色时溶液的pH<8,故B错误;
C.常温下,中性溶液的pH=7,酸溶液中酸电离的H+抑制水的电离,常温下酸溶液的pH一定小于7,1.0×10-8molL-1盐酸呈酸性,溶液的pH应小于7,不可能等于8.0,故C错误;
D.1mL pH=1的盐酸的浓度为0.1mol/L,该盐酸与100mLNaOH溶液混合后溶液的pH=7,说明两溶液恰好反应,则n(NaOH)=n(HCl)=0.1mol/L×0.001L=1×10-4mol/L,则NaOH溶液的浓度为:![]() =1×10-3mol/L,该NaOH溶液的pH=11,故D正确;
=1×10-3mol/L,该NaOH溶液的pH=11,故D正确;
故答案为D。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】下面四种变化中,有一种变化与其他三种变化类型不同的是 ( )
A. CH3CH2OH + CH3COOH![]() CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
B. CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
C. 2CH3CH2OH![]() CH3CH2OCH2CH3 + H2O
CH3CH2OCH2CH3 + H2O
D. CH3CH2OH + HBr![]() CH3CH2Br + H2O
CH3CH2Br + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是
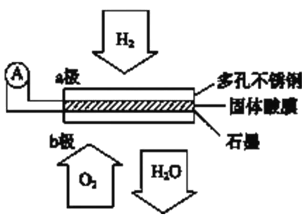
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e--=4OH--
C. 每转移0.1mol电子,消耗1.12L的H2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前比较热门的Al-H2O2电池,其电池总反应为2Al+![]() =
=![]() +OH-+H2O。现以AlH2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法正确的是
+OH-+H2O。现以AlH2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法正确的是
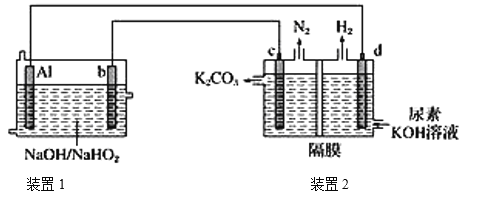
A.装置1中Na+移向电极b,装置2中的隔膜可以换成质子交换膜
B.电极c的电极反应式:CO(NH2)2-6e-+8OH-=CO32-+N2↑+6H2O
C.电解时,电流的流动路径:Al极→导线→d极→电解质溶液→c极→导线→b极
D.通电5 min后,若Al电极的质量减轻5.4g,则产生H2的体积为4.48L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾晶体{K3[Fe(C2O4)3]·3H2O}易溶于水,难溶于乙醇,可用于摄影和蓝色印刷。三草酸合铁酸钾晶体在110 ℃可完全失去结晶水,继续升高温度可发生分解反应。
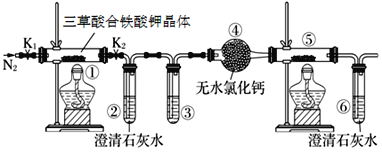
(1)分解得到的气体产物用如下装置进行实验:检查装置气密性后先通一段时间的N2,其目的是_____________;为了实验安全,应先点燃___________________(①或⑤)处的酒精灯;
(2)若③和⑤中分别盛放_____________ 、_______________就可检验生成的CO;
(3)分解得到的固体产物含有K2CO3、FeO、Fe,加水溶解、过滤、洗涤、干燥,得到含铁样品。现设计下列两种实验方案对该样品进行铁元素含量测定:
(甲)a g样品![]() 溶液
溶液![]()
![]() 得固体b g
得固体b g
(乙)a g样品![]() 配制250 mL溶液
配制250 mL溶液![]() ,三次平均消耗0.1 mol·L-1酸性KMnO4溶液V mL.
,三次平均消耗0.1 mol·L-1酸性KMnO4溶液V mL.
你认为以上________(填“甲”或“乙”)方案可确定样品的组成,测得铁元素的含量是__________,不可确定样品组成的方案的理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解NO制备 NH4NO3的工作原理如图所示,X、Y皆Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A。下列说法正确的是( )
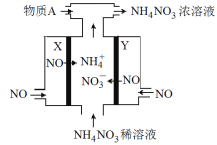
A. 物质A为NH3
B. X电极为电解池阳极
C. Y电极上发生了还原反应
D. Y电极反应式为:NO-3e-+4OH-==NO3-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见反应的化学方程式有A+B→X+Y+H2O或H2O+A+B→X+Y(未配平,反应条件略去),下列问题所涉及反应是上述两个方程式之一。请回答:
(1)常温下,若A为黄绿色气体,B为非金属氧化物,A、B均能使品红溶液褪色,A+B+H2O→X+Y,则该反应的化学方程式_________________
(2)若A为金属单质,其与B的浓溶液常温钝化而加热则可以反应,而且所得的三种产物在常温下又可以发生反应,则作氧化剂的B与表现酸性的B的物质的量之比是_____。
(3)若A为常见的非金属单质,B的溶液为某浓酸,其中A、B的物质的量之比为1∶4,而且该反应能产生一种造成光化学烟雾的气体,则该反应化学方程式为_______________
(4)若A、B均为化合物,Y为白色沉淀(不含金属元素),B为引起温室效应的主要气体,写出B(过量)与A反应生成Y的离子方程式________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】长期存放的亚硫酸钠可能会被空气中的氧气氧化。某化学兴趣小组通过实验来测定某无水亚硫酸钠试剂的质量分数,设计了如图所示实验装置:
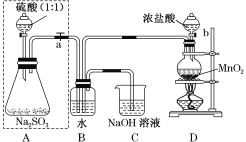
请回答下面的问题:
(1)若将虚线框内的分液漏斗换成长颈漏斗,则应该怎样检查虚线框内装置的气密性?________。
(2)D装置中反应的化学方程式为_________。B装置中反应的离子方程式为__________。
(3)称量a g Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应,过滤、洗涤、干燥,得白色沉淀b g,原样品中Na2SO3的质量分数为______。
(4)C装置中反应的离子方程式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com