
【题目】电解NO制备 NH4NO3的工作原理如图所示,X、Y皆Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A。下列说法正确的是( )
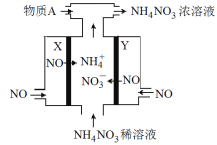
A. 物质A为NH3
B. X电极为电解池阳极
C. Y电极上发生了还原反应
D. Y电极反应式为:NO-3e-+4OH-==NO3-+2H2O
【答案】A
【解析】
试题A、根据装置图可知电解NO制备NH4NO3,NO分别在阴阳两极放电,其中阳极反应式为NO-3e-+2H2O=NO3-+4H+,阴极反应式为NO+5e-+6H+=NH4++H2O。从两极反应可看出,要满足得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O![]() 3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,A正确;B、根据装置图可知X电极产生铵根,因此X电极是阴极,B错误;C、根据以上分析可知Y电极是阳极,失去电子发生氧化反应,C错误;D、硝酸铵溶液显酸性,则根据以上分析可知,阳极电极反应式为NO-3e-+2H2O=NO3-+4H+,D错误,答案选A。
3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,A正确;B、根据装置图可知X电极产生铵根,因此X电极是阴极,B错误;C、根据以上分析可知Y电极是阳极,失去电子发生氧化反应,C错误;D、硝酸铵溶液显酸性,则根据以上分析可知,阳极电极反应式为NO-3e-+2H2O=NO3-+4H+,D错误,答案选A。


科目:高中化学 来源: 题型:
【题目】如图,是实验室制备乙酸乙酯的装置。a试管中加入3mL95%的乙醇、2mL浓硫酸、2mL冰醋酸;b试管中是饱和碳酸钠溶液。连接好装置,用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。
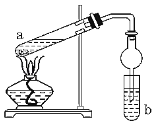
(1)在a试管中除了加入乙醇、浓硫酸和乙酸外,还应放入__,目的是__。
(2)试管b中观察到的主要现象是__。
(3)实验中球形干燥管除起冷凝作用外,另一个重要作用是__。
(4)饱和Na2CO3溶液的作用是__。
(5)反应结束后,将试管中收集到的产品倒入分液漏斗中,__、__,然后分液,得到乙酸乙酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列几组物质:
①16O2和18O3②35Cl和37Cl-③金刚石和石墨④12C和16C⑤1H2O和D2O⑥CH4与C7H16⑦C2H4和C3H6⑧淀粉和纤维素⑨CH3CH2CH2CH3和![]() ⑩CH3CH(CH3)CH2CH2CH3和CH3CH2CH2(CH3)CHCH3
⑩CH3CH(CH3)CH2CH2CH3和CH3CH2CH2(CH3)CHCH3 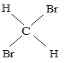 和
和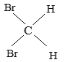
![]() 和
和![]()
(1)互为同位素___;
(2)互为同素异形体___;
(3)互为同系物___;
(4)互为同分异构体___;
(5)为同一物质___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为锌铜原电池示意图,下列说法错误的是( )
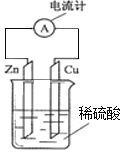
A.锌片为负极,且锌片逐渐溶解
B.电子由锌片通过导线流向铜片
C.铜为正极,铜不易失电子而受到保护
D.溶液中阳离子向![]() 极移动,且
极移动,且![]() 极上发生的是氧化反应
极上发生的是氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
B. 在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液pH<7
C. 常温下,1.0×10—3mol/L盐酸的pH=3.0,1.0×10—8mol/L盐酸pH=8.0
D. 常温下,若1mLpH=1盐酸与100mLNaOH溶液混合后,溶液pH=7,则NaOH溶液的pH=11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是( )

A. NaHB溶液可能为酸性,也可能为碱性
B. A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C. E溶液中离子浓度大小关系:c(NH4+)>c(B2-)>c(OH-)>c(H+)
D. F点溶液c(NH4+)=2c(B2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CO还原脱硝技术可有效降低烟气中的NOx的排放量。回答下列问题:
CO还原NO的脱硝反应:2CO(g)+2NO(g)2CO2(g)+N2(g) △H
已知:CO(g)+NO2(g)CO2(g)+NO(g) △H1=—226kJmol—1
N2(g)+2O2(g)2NO2(g) △H2=+68kJmol—1
N2(g)+O2(g)2NO(g) △H3=+183kJmol—1
脱硝反应△H=______,该反应向正反应方向自发进行的倾向很大,其原因是_______,有利于提高NO平衡转化率的条件是(写出两条)________、___________。
(2)直接供氨式燃料电池是以NaOH溶液为电解质的.电池反应为:4NH3+3O2=2N2+6H2O,则负极电极反应式为_________。
(3)用甲醇燃料电池作为直流电源,设计如图装置制取Cu2O,电解总反应为:2Cu+H2O=Cu2O+H2↑。写出阳极的电极反应式_______。
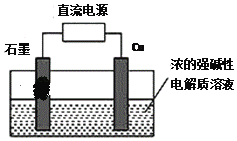
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)在溶液中会生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是

A. HClO2的电离平衡常数的数值Ka=10-8
B. pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有:c(Na+)+c(OH-)=c(H+)+ c(HClO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是( )
A. 相同质量的CO与N2,所含分子数、原子数均相同
B. 31g白磷中所含共价键数目为NA
C. 56g乙烯中所含共用电子对数目为12NA
D. 14g乙烯与丙烯的混合气体中所含氢原子数目为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com