
【题目】(1)CO还原脱硝技术可有效降低烟气中的NOx的排放量。回答下列问题:
CO还原NO的脱硝反应:2CO(g)+2NO(g)2CO2(g)+N2(g) △H
已知:CO(g)+NO2(g)CO2(g)+NO(g) △H1=—226kJmol—1
N2(g)+2O2(g)2NO2(g) △H2=+68kJmol—1
N2(g)+O2(g)2NO(g) △H3=+183kJmol—1
脱硝反应△H=______,该反应向正反应方向自发进行的倾向很大,其原因是_______,有利于提高NO平衡转化率的条件是(写出两条)________、___________。
(2)直接供氨式燃料电池是以NaOH溶液为电解质的.电池反应为:4NH3+3O2=2N2+6H2O,则负极电极反应式为_________。
(3)用甲醇燃料电池作为直流电源,设计如图装置制取Cu2O,电解总反应为:2Cu+H2O=Cu2O+H2↑。写出阳极的电极反应式_______。
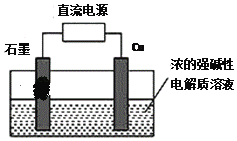
【答案】-750kJ/mol 该反应为放热量大的反应 降温 升压或增大CO和NO的投料比等 NH3+6OH--6e-=N2+6H2O 2Cu+2OH--2e-=Cu2O+H2O
【解析】
(1)已知:①CO(g)+NO2(g)CO2(g)+NO(g)△H1=-226kJmol-1,②N2(g)+2O2(g)2NO2(g)△H2=+68kJmol-1,③N2(g)+O2(g)2NO(g)△H3=+183kJmol-1,盖斯定律计算①×2+②-③×2得到2CO(g)+2NO(g)2CO2(g)+N2(g)△H;该反应向正反应方向自发进行的倾向很大,说明反应放热多,根据外界条件对化学平衡的影响分析有利于提高NO 平衡转化率的方法;
(2)根据原电池工作原理及电极反应写出该燃料电池的负极反应式;
(3)由总的反应式2Cu+H2O=Cu2O+H2↑可知:铜的化合价升高,被氧化,是电解池的阳极,铜最后生成氧化亚铜,由此写出阳极电极反应式。
(1)已知:①CO(g)+NO2(g)CO2(g)+NO(g)△H1=-226kJmol-1,②N2(g)+2O2(g)2NO2(g)△H2=+68kJmol-1,③N2(g)+O2(g)2NO(g)△H3=+183kJmol-1,盖斯定律计算①×2+②-③×2得到2CO(g)+2NO(g)2CO2(g)+N2(g)△H=-750kJ/mol;该反应向正反应方向自发进行的倾向很大,其原因是该反应为放热量大的反应,反应为气体体积减小的放热反应,有利于提高NO 平衡转化率的条件是:降温、升压、增大CO和NO的投料比等;
(2)原电池负极失去电子发生氧化反应,所以该燃料电池中负极氨气失去电子生成氮气,电极反应式为2NH3+6OH--6e-=N2+6H2O;
(3)由总的反应式2Cu+H2O=Cu2O+H2↑可知:铜的化合价升高,被氧化,是电解池的阳极,电极反应式为:2Cu+2OH--2e-=Cu2O+H2O。


科目:高中化学 来源: 题型:
【题目】一种微生物燃料电池的结构示意图如下所示,关于该电池的叙述正确的是( )
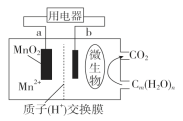
A. 电池工作时,电子由a流向b
B. 微生物所在电极区放电时发生还原反应
C. 放电过程中,H+从正极区移向负极区
D. 正极反应式为:MnO2+4H++2e-===Mn2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前比较热门的Al-H2O2电池,其电池总反应为2Al+![]() =
=![]() +OH-+H2O。现以AlH2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法正确的是
+OH-+H2O。现以AlH2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法正确的是
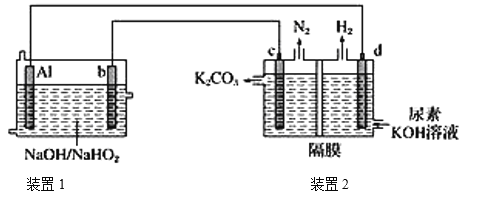
A.装置1中Na+移向电极b,装置2中的隔膜可以换成质子交换膜
B.电极c的电极反应式:CO(NH2)2-6e-+8OH-=CO32-+N2↑+6H2O
C.电解时,电流的流动路径:Al极→导线→d极→电解质溶液→c极→导线→b极
D.通电5 min后,若Al电极的质量减轻5.4g,则产生H2的体积为4.48L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解NO制备 NH4NO3的工作原理如图所示,X、Y皆Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A。下列说法正确的是( )
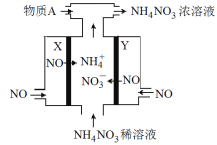
A. 物质A为NH3
B. X电极为电解池阳极
C. Y电极上发生了还原反应
D. Y电极反应式为:NO-3e-+4OH-==NO3-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用邻苯二甲酸氢钾,(分子式为![]() 相对分子质量为204)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol/L左右,滴定终点时溶液的pH约为9.1。
相对分子质量为204)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol/L左右,滴定终点时溶液的pH约为9.1。
(1)写出邻苯二甲酸氢钾与NaOH反应的化学方程式:________。
(2)将用分析天平精确称量的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液无色,再加入指示剂_____(从甲基橙、酚酞、石蕊中选择),用NaOH溶液滴定到终点时,现象是________。
(3)该实验要用到的主要玻璃仪器_______、______。
(4)该学生进行三次实验,所取固体的质量均相同,填写下表:
实验 编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
1 | 0.4488 | 22.24 |
2 | 20.04 | |
3 | 19.96 |
滴定中误差较大的是第_____次实验,造成这种误差的可能原因是_____
a.滴定时有NaOH溶液滴到锥形瓶外面;
b.未用NaOH溶液润洗滴定管;
c.NaOH溶液在“0”刻度线以上,未予调整就开始滴定;
d.观察记录滴定管内液面刻度时滴定前仰视,滴定后俯视;
e.酚酞指示剂由无色变为红色时立即停止滴定。
(5)NaOH溶液的物质的量浓度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见反应的化学方程式有A+B→X+Y+H2O或H2O+A+B→X+Y(未配平,反应条件略去),下列问题所涉及反应是上述两个方程式之一。请回答:
(1)常温下,若A为黄绿色气体,B为非金属氧化物,A、B均能使品红溶液褪色,A+B+H2O→X+Y,则该反应的化学方程式_________________
(2)若A为金属单质,其与B的浓溶液常温钝化而加热则可以反应,而且所得的三种产物在常温下又可以发生反应,则作氧化剂的B与表现酸性的B的物质的量之比是_____。
(3)若A为常见的非金属单质,B的溶液为某浓酸,其中A、B的物质的量之比为1∶4,而且该反应能产生一种造成光化学烟雾的气体,则该反应化学方程式为_______________
(4)若A、B均为化合物,Y为白色沉淀(不含金属元素),B为引起温室效应的主要气体,写出B(过量)与A反应生成Y的离子方程式________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用NaOH溶液滴定H2C2O4溶液,溶液中-lg[c(H+)/c(H2C2O4)]和-lgc(HC2O4-)或-lg[c(H+)/c(HC2O4-)]和-lgc(C2O42-)关系如图所示,下列说法错误的是( )
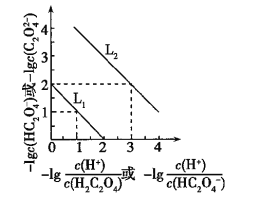
A. Ka1(H2C2O4)=1×10-2
B. 滴定过程中,当pH=5时,C(Na+)-3C(HC2O4-)>0
C. 向1 mol/L的H2C2O4溶液中加入等体积等浓度的NaOH溶液,完全反应后显酸性
D. 向0.1 mol/L的H2C2O4溶液中加水稀释,C(HC2O4-)/C(H2C2O4)比值将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:2SO2+O2![]() 2SO3(g),已知反应过程中某一时刻SO2、O2和SO3浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,可能存在的数据是
2SO3(g),已知反应过程中某一时刻SO2、O2和SO3浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,可能存在的数据是
A.SO2为0.4 mol·L-1、O2为0.2 mol·L-1B.SO2为0.3 mol·L-1
C.SO3为0.4 mol·L-1D.SO2、SO3均为0.1 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com