
【题目】常温下,用NaOH溶液滴定H2C2O4溶液,溶液中-lg[c(H+)/c(H2C2O4)]和-lgc(HC2O4-)或-lg[c(H+)/c(HC2O4-)]和-lgc(C2O42-)关系如图所示,下列说法错误的是( )
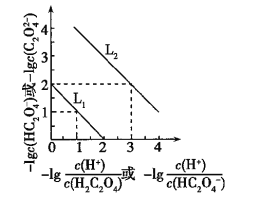
A. Ka1(H2C2O4)=1×10-2
B. 滴定过程中,当pH=5时,C(Na+)-3C(HC2O4-)>0
C. 向1 mol/L的H2C2O4溶液中加入等体积等浓度的NaOH溶液,完全反应后显酸性
D. 向0.1 mol/L的H2C2O4溶液中加水稀释,C(HC2O4-)/C(H2C2O4)比值将增大
【答案】B
【解析】
二元弱酸的电离平衡常数![]() ,斜线
,斜线![]() 表示c(H+)/c(H2C2O4)与c(HC2O4-)的乘积等于1×10-2,斜线
表示c(H+)/c(H2C2O4)与c(HC2O4-)的乘积等于1×10-2,斜线![]() 表示c(H+)/c(HC2O4-)与c(C2O42-)的乘积等于1×10-5。
表示c(H+)/c(HC2O4-)与c(C2O42-)的乘积等于1×10-5。
A、根据图示,Ka1(H2C2O4)=![]() =1×10-2,故A正确;
=1×10-2,故A正确;
B、根据电荷守恒C(Na+)+ C(H+)= c(HC2O4-)+2c(C2O42-)+ c(OH-),根据图示,Ka2(H2C2O4)=![]() ,当pH=5时,c(HC2O4-)=c(C2O42-),所以C(Na+) -3C(HC2O4-)= c(OH-)- C(H+)=
,当pH=5时,c(HC2O4-)=c(C2O42-),所以C(Na+) -3C(HC2O4-)= c(OH-)- C(H+)=![]() ,故B错误;
,故B错误;
C、向1 mol/L的H2C2O4溶液中加入等体积等浓度的NaOH溶液,溶液中的溶质是NaHC2O4,HC2O4-电离平衡常数是1×10-5、水解平衡常数是![]() ,所以,草酸氢根离子的电离常数大于其水解常数,因此该溶液呈酸性,故C正确;
,所以,草酸氢根离子的电离常数大于其水解常数,因此该溶液呈酸性,故C正确;
D、Ka1(H2C2O4)=![]() ,向0.1 mol/L的H2C2O4溶液中加水稀释,氢离子浓度减小,K不变,所以C(HC2O4-)/C(H2C2O4)比值将增大,故D正确。
,向0.1 mol/L的H2C2O4溶液中加水稀释,氢离子浓度减小,K不变,所以C(HC2O4-)/C(H2C2O4)比值将增大,故D正确。


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】下列几组物质:
①16O2和18O3②35Cl和37Cl-③金刚石和石墨④12C和16C⑤1H2O和D2O⑥CH4与C7H16⑦C2H4和C3H6⑧淀粉和纤维素⑨CH3CH2CH2CH3和![]() ⑩CH3CH(CH3)CH2CH2CH3和CH3CH2CH2(CH3)CHCH3
⑩CH3CH(CH3)CH2CH2CH3和CH3CH2CH2(CH3)CHCH3 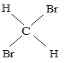 和
和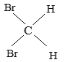
![]() 和
和![]()
(1)互为同位素___;
(2)互为同素异形体___;
(3)互为同系物___;
(4)互为同分异构体___;
(5)为同一物质___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CO还原脱硝技术可有效降低烟气中的NOx的排放量。回答下列问题:
CO还原NO的脱硝反应:2CO(g)+2NO(g)2CO2(g)+N2(g) △H
已知:CO(g)+NO2(g)CO2(g)+NO(g) △H1=—226kJmol—1
N2(g)+2O2(g)2NO2(g) △H2=+68kJmol—1
N2(g)+O2(g)2NO(g) △H3=+183kJmol—1
脱硝反应△H=______,该反应向正反应方向自发进行的倾向很大,其原因是_______,有利于提高NO平衡转化率的条件是(写出两条)________、___________。
(2)直接供氨式燃料电池是以NaOH溶液为电解质的.电池反应为:4NH3+3O2=2N2+6H2O,则负极电极反应式为_________。
(3)用甲醇燃料电池作为直流电源,设计如图装置制取Cu2O,电解总反应为:2Cu+H2O=Cu2O+H2↑。写出阳极的电极反应式_______。
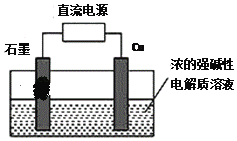
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)在溶液中会生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是

A. HClO2的电离平衡常数的数值Ka=10-8
B. pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有:c(Na+)+c(OH-)=c(H+)+ c(HClO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧硫化碳(COS,结构类似于CO2)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。有多种方法可以脱氧硫化碳中的硫,其中氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g) +H2(g)![]() H2S(g) + CO(g) ΔH1= +7kJ/mol
H2S(g) + CO(g) ΔH1= +7kJ/mol
②水解反应:COS(g) +H2O(g)![]() H2S(g) +CO2(g) ΔH2=-35kJ/mol
H2S(g) +CO2(g) ΔH2=-35kJ/mol
请回答下列问题:
(1)氧硫化碳的电子式为_____。
(2)CO和H2O(g)能反应生成CO2和H2,写出该反应的热化学方程式_______。
(3)水解反应达到平衡后,若减小容器的体积,逆反应速率将_____(填增大、减少或不变,下同),COS的转化率____。
(4)某温度下,体积为2L的恒容体系中,物质的量分别为mmol、nmol的COS蒸气和H2气发生氢解,已知COS的转化率为α,则该温度下的平衡常数K= ____(用m、n、α等符号表示)。
(5)某科研小组研究改进催化剂TiO2/Al2O3和温度对COS水解的影响,得到如图

COS水解的最佳温度是________;理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
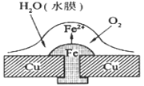
A. 此过程中铜并不被腐蚀
B. 此过程中正极电极反应式为:2H++2e- = H2↑
C. 此过程中电子从Fe移向Cu
D. 此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。该电池是以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液,其总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列说法正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列说法正确的是
A.Zn为电池的正极
B.充电时阳极反应为:Fe(OH)3-3e+5OH =FeO42-+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.该电池放电过程中电解质溶液浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是( )
A. 相同质量的CO与N2,所含分子数、原子数均相同
B. 31g白磷中所含共价键数目为NA
C. 56g乙烯中所含共用电子对数目为12NA
D. 14g乙烯与丙烯的混合气体中所含氢原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol L-1HB溶液中逐滴滴入 0.1mol L-1NaOH溶液,所得 PH变化曲线如图所示。下列说法错误的是

A.OA各点溶液均存在:c(B-) >c(Na+)
B.C至 D各点溶液导电能力依次增强
C.点 O时,pH>1
D.点 C时,X约为 10.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com