
【题目】长期存放的亚硫酸钠可能会被空气中的氧气氧化。某化学兴趣小组通过实验来测定某无水亚硫酸钠试剂的质量分数,设计了如图所示实验装置:
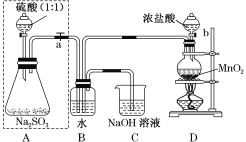
请回答下面的问题:
(1)若将虚线框内的分液漏斗换成长颈漏斗,则应该怎样检查虚线框内装置的气密性?________。
(2)D装置中反应的化学方程式为_________。B装置中反应的离子方程式为__________。
(3)称量a g Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应,过滤、洗涤、干燥,得白色沉淀b g,原样品中Na2SO3的质量分数为______。
(4)C装置中反应的离子方程式为_____________。
【答案】关闭弹簧夹(或止水夹)a,由长颈漏斗向锥形瓶内加水至漏斗内液面高于锥形瓶内液面,过一段时间观察液面是否变化,若不变,说明气密性良好,否则,说明装置漏气 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O Cl2+SO2+2H2O=4H++2Cl-+
MnCl2+Cl2↑+2H2O Cl2+SO2+2H2O=4H++2Cl-+![]()
![]() ×100% Cl2+2OH-=Cl-+ClO-+H2O
×100% Cl2+2OH-=Cl-+ClO-+H2O
【解析】
在A装置中,硫酸与Na2SO3发生反应Na2SO3+H2SO4==Na2SO4+H2O+SO2↑;生成的SO2通入B装置中;D装置中,浓盐酸与MnO2在加热条件下发生反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,生成的Cl2通入B装置中,与SO2在水中发生反应Cl2+SO2+2H2O==H2SO4+2HCl;为确保SO2全部转化为H2SO4,通入的Cl2应过量,过量的Cl2在C装置内被NaOH溶液吸收,发生反应的化学方程式为Cl2+2NaOH==NaCl+NaClO+H2O。
MnCl2+Cl2↑+2H2O,生成的Cl2通入B装置中,与SO2在水中发生反应Cl2+SO2+2H2O==H2SO4+2HCl;为确保SO2全部转化为H2SO4,通入的Cl2应过量,过量的Cl2在C装置内被NaOH溶液吸收,发生反应的化学方程式为Cl2+2NaOH==NaCl+NaClO+H2O。
(1)若将虚线框内的分液漏斗换成长颈漏斗,则应该从长颈漏斗往锥形瓶内添加水,通过形成液面差,确定装置的气密性,具体操作为:关闭弹簧夹(或止水夹)a,由长颈漏斗向锥形瓶内加水至漏斗内液面高于锥形瓶内液面,过一段时间观察液面是否变化,若不变,说明气密性良好,否则,说明装置漏气。答案为:关闭弹簧夹(或止水夹)a,由长颈漏斗向锥形瓶内加水至漏斗内液面高于锥形瓶内液面,过一段时间观察液面是否变化,若不变,说明气密性良好,否则,说明装置漏气;
(2)D装置中,MnO2与浓盐酸在加热条件下发生氧化还原反应,成MnCl2、Cl2和H2O,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。B装置中,SO2、Cl2与水发生氧化还原反应,生成两种酸,反应的离子方程式为Cl2+SO2+2H2O=4H++2Cl-+
MnCl2+Cl2↑+2H2O。B装置中,SO2、Cl2与水发生氧化还原反应,生成两种酸,反应的离子方程式为Cl2+SO2+2H2O=4H++2Cl-+![]() 。答案为:MnO2+4HCl(浓)
。答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;Cl2+SO2+2H2O=4H++2Cl-+
MnCl2+Cl2↑+2H2O;Cl2+SO2+2H2O=4H++2Cl-+![]() ;
;
(3)反应生成的bg白色沉淀为BaSO4,则由反应可建立下列关系式:Na2SO3——BaSO4,则原样品中Na2SO3的质量分数为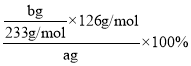 =
=![]() ×100%。答案为:
×100%。答案为:![]() ×100%;
×100%;
(4)C装置中,Cl2被NaOH溶液吸收,发生反应的化学方程式为Cl2+2NaOH==NaCl+NaClO+H2O,则反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。答案为:Cl2+2OH-


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
B. 在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液pH<7
C. 常温下,1.0×10—3mol/L盐酸的pH=3.0,1.0×10—8mol/L盐酸pH=8.0
D. 常温下,若1mLpH=1盐酸与100mLNaOH溶液混合后,溶液pH=7,则NaOH溶液的pH=11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧硫化碳(COS,结构类似于CO2)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。有多种方法可以脱氧硫化碳中的硫,其中氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g) +H2(g)![]() H2S(g) + CO(g) ΔH1= +7kJ/mol
H2S(g) + CO(g) ΔH1= +7kJ/mol
②水解反应:COS(g) +H2O(g)![]() H2S(g) +CO2(g) ΔH2=-35kJ/mol
H2S(g) +CO2(g) ΔH2=-35kJ/mol
请回答下列问题:
(1)氧硫化碳的电子式为_____。
(2)CO和H2O(g)能反应生成CO2和H2,写出该反应的热化学方程式_______。
(3)水解反应达到平衡后,若减小容器的体积,逆反应速率将_____(填增大、减少或不变,下同),COS的转化率____。
(4)某温度下,体积为2L的恒容体系中,物质的量分别为mmol、nmol的COS蒸气和H2气发生氢解,已知COS的转化率为α,则该温度下的平衡常数K= ____(用m、n、α等符号表示)。
(5)某科研小组研究改进催化剂TiO2/Al2O3和温度对COS水解的影响,得到如图

COS水解的最佳温度是________;理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。该电池是以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液,其总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列说法正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列说法正确的是
A.Zn为电池的正极
B.充电时阳极反应为:Fe(OH)3-3e+5OH =FeO42-+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.该电池放电过程中电解质溶液浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态钛原子的价电子排布式为_____________,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有____________种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料,钛的硬度比铝大的原因是_________。
(3)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配合离子的化学式为___________。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如图所示。
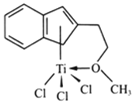
①组成M的元素中,电负性最大的是_________(填名称)。
②M中碳原子的杂化方式为____________。
③M中不含________(填代号)。
a.π键 b.σ键 c.离子键 d.配位键
(5)金红石(TiO2)是含钛的主要矿物之一。其晶胞结构(晶胞中相同位置的原子相同)如图所示。
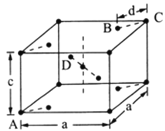
①A、B、C、D4种微粒,其中氧原子是________(填代号)。
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,____,___);钛氧键的键长d=______(用代数式表示)。
③若晶胞底边长为a cm,高为c cm,则TiO2晶体的密度为______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是( )
A. 相同质量的CO与N2,所含分子数、原子数均相同
B. 31g白磷中所含共价键数目为NA
C. 56g乙烯中所含共用电子对数目为12NA
D. 14g乙烯与丙烯的混合气体中所含氢原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中I、II两个反应属于同一反应类型的是( )
选项 | 反应I | 反应II |
A |
| CH2=CH2→CH3CH2Cl |
B | CH3CH2Cl→CH3CH2OH | CH3CH2OH→CH3COOCH2CH3 |
C | CH3CH2OH→CH2=CH2 | CH3CH2OH→CH3CHO |
D | 油脂→甘油 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2,5-二羟基苯甲酸甲酯俗称龙胆酸甲酯,可由龙胆酸与甲醇酯化得到,是合成制药中的常见中间体。其结构如图所示。
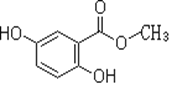
回答以下问题:
(1)龙胆酸甲酯的分子式为__________
(2)下列有关龙胆酸甲酯的描述,正确的是_____(填字母)。
a.能发生消去反应 b.能与氢气发生加成反应 c.能与浓溴水反应
(3)龙胆酸甲酯与足量氢氧化钠溶液反应的化学方程式_________ 。
(4)写出满足下列条件的龙胆酸的两种同分异构体的结构简式_______、_______。
①能发生银镜反应; ②能使FeCl3溶液显色;
③酯类 ④苯环上的一氯代物只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)![]() xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
A. 反应速率v(B)=0.25 mol·L-1·min-1
B. 该反应方程式中x=1
C. 2min时,A的物质的量为1.5mol
D. 2min时,A的转化率为60%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com