
【题目】H2C2O4为二元弱酸。回答下列问题:
(1)20℃时,配制一组c(H2C2O4)+c(HC2O4-)+ c(C2O42-)=0.100 mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如下图所示。
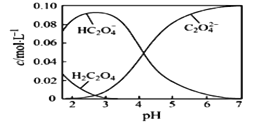
①H2C2O4的电离方程式为___________。
②为获得尽可能纯的NaHC2O4,pH应控制在_______左右。
③NaHC2O4溶液呈酸性,其原因为_________________。
④pH=6时,溶液中含碳微粒浓度大小关系为_______________。
(2)常温下,草酸、碳酸的电离平衡常数如下:
化学式 | H2CO3 | H2C2O4 |
平衡常数 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=5.6×10-2 Ka2=5.4×10-5 |
①常温下,0.1 mol·L-1 Na2CO3溶液的pH____0.1 mol·L-1 Na2C2O4溶液的pH。(填“>”、“<”或“=”)
② pH=4的H2C2O4溶液中c(C2O42-):c(HC2O4-)=_________。
【答案】H2C2O4![]() H+ + HC2O4- 2.5~3之间任一数值均可 HC2O4-的电离程度大于其水解程度 c(C2O42-)>c( HC2O4-)>c(H2C2O4) > 0.54
H+ + HC2O4- 2.5~3之间任一数值均可 HC2O4-的电离程度大于其水解程度 c(C2O42-)>c( HC2O4-)>c(H2C2O4) > 0.54
【解析】
(1)①根据图像H2C2O4溶液中存在的微粒可知H2C2O4多元弱酸,因此分步电离,第一步为主;
②根据图像可以看出pH=2.5~3, HC2O4-的浓度最大;
③利用弱酸的酸式酸根离子的电离平衡和水解平衡进行分析;
④根据图像分析横坐标pH=6时,微粒的浓度大小。
(2)①根据电离常数可知:HC2O4-酸性大于HCO3-,利用越弱越水解原理,可知CO32-的水解能力强于C2O42-;
②根据H2C2O4的第二步电离常数计算;
(1)①多元弱酸分步电离,第一步为主,H2C2O4的电离方程式为H2C2O4![]() H+ + HC2O4-;
H+ + HC2O4-;
答案:H2C2O4![]() H+ + HC2O4-
H+ + HC2O4-
②根据图像可以看出,当pH在2.5~3的范围内, HC2O4-的浓度最大,所以,为获得尽可能纯的NaHC2O4,pH控制在2.5~3之间任一数值均可;
答案:2.5~3之间任一数值均可
③HC2O4-存在两个平衡,电离平衡HC2O4-![]() H+ + C2O42-,水解平衡HC2O4-+H2O
H+ + C2O42-,水解平衡HC2O4-+H2O![]() OH- + H2C2O4,由于HC2O4-电离程度大于水解程度,所以溶液呈酸性;
OH- + H2C2O4,由于HC2O4-电离程度大于水解程度,所以溶液呈酸性;
答案:HC2O4-的电离程度大于其水解程度
④根据图像分析当横坐标pH=6时,纵坐标可以看出溶液中含碳微粒浓度大小关系为c(C2O42-)>c( HC2O4-)>c(H2C2O4);
答案:c(C2O42-)>c( HC2O4-)>c(H2C2O4)
(2)①根据电离常数可知:HC2O4-酸性大于HCO3-,根据越弱越水解原理可知,CO32-的水解能力强于C2O42-,所以常温下,0.1 mol·L-1 Na2CO3溶液的pH大于0.1 mol·L-1 Na2C2O4溶液的pH。
答案:>
②根据H2C2O4的第二步电离常数计算:Ka2=5.4×10-5=![]() =
=![]() ,可得
,可得
pH=4的H2C2O4溶液中c(C2O42-):c(HC2O4-)=0.54;
答案:0.54


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】下面列出了几组物质,请将物质的合适组号填写在空格上。
① 金刚石与石墨; ②乙酸和醋酸
③ 16O和18O; ④CH3CH3和CH3CH2CH3;
⑤![]() 和
和
(1)同种物质______________________________;
(2)同位素_________________________;
(3)同素异形体______________________________;
(4)同系物__________________________;
(5)同分异构体______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备下列物质的生产流程合理的是( )
A. 由铝土矿冶炼铝:铝土矿![]() Al2O3
Al2O3![]() AlCl3
AlCl3![]() Al
Al
B. 从海水中提取镁:海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
C. 由NaCl制漂白粉:饱和食盐水![]() Cl2
Cl2![]() 漂白粉
漂白粉
D. 由黄铁矿制硫酸:黄铁矿![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铜的金属活泼性比铁的弱,可在海轮外壳上镶入若干铜块以减缓其腐蚀
B. 向0.1 mol·L-1 CH3COONa溶液中加入少量水,溶液中c(H+)/c(CH3COO-)减小
C. 反应TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g);ΔH>0能自发进行,其原因是ΔS>0
D. 一定温度下,增大反应2BaO2(s)![]() 2BaO(s) +O2(g)容器的体积,平衡不移动
2BaO(s) +O2(g)容器的体积,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断开 1mol Cl2(g)中Cl-Cl键需要吸收243kJ能量,根据能量变化示意图,下列说法或热化学方程式正确的是( )
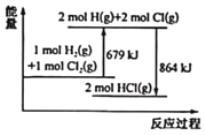
A.H2(g)+Cl2(g) = 2HCl(g) ΔH= + 185 kJ·mol-1
B.生成1mol H2(g)中的H-H键放出 121.5 kJ 能量
C.断开1mol HCl(g)中的H-C1键要吸收 864 kJ 能量
D.HCl(g) =![]() H2(g)+
H2(g)+![]() Cl2(g) ΔH= + 92.5kJ·mol-1
Cl2(g) ΔH= + 92.5kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理对化学反应的研究具有指导意义。
(1)机动车废气排放已成为城市大气污染的重要来源。气缸中生成NO的反应为:N2(g)+O2(g) ![]() 2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点可能的原因___________、_____________。
2NO(g) △H >0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点可能的原因___________、_____________。
(2)由金红石TiO2制取单质Ti,涉及到的步骤为:
TiO2![]() TiCl4
TiCl4![]() Ti
Ti
已知:①Cs+O2g=CO2g; H=3935 kJ·mol1
②2COg+O2g=2CO2g; H=566 kJ·mol1
③TiO2s+2Cl2g=TiCl4s+O2g; H=+141 kJ·mol1
则TiO2s+2Cl2g+2Cs=TiCl4s+2COg的H=________________。
(3)氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有1/3与水反应。该反应的化学方程式为______,在上述平衡体系中加入少量NaOH固体,溶液中Cl—浓度_______(选填“增大”、“减小”或“不变”)。
(4)一定条件下,Fe3+和I—在水溶液中的反应是2I—+2Fe3+![]() I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向_______(选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案_____。
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向_______(选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的实验方案_____。
(5)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅰⅰ.![]()
![]()
①写出此条件下,反应A的热化学方程式___________。
②断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为__________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有一反应:3Fe2++2S2O32—+O2+xOH-===Fe3O4+S4O62—+2H2O,下列说法中不正确的是( )
A.x=4
B.1molFe2+被氧化时,被Fe2+还原的O2的物质的量为![]() mol
mol
C.Fe2+和S2O32—都是还原剂
D.每生成1molFe3O4,反应转移的总电子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A(g)+4B(g)![]() 2C(g)+2D(g),下列数据表示反应进行得最快的是( )
2C(g)+2D(g),下列数据表示反应进行得最快的是( )
A.v(A)=1.4mol/(Ls)B.v(B)=3.6 mol/(Ls)
C.v(C)=2mol/(Ls)D.v(D)=30 mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4=HBr+NaHSO4①
R—OH+HBr![]() R—Br+H2O②
R—Br+H2O②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据见下表:
乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
密度/g.cm3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)溴乙烷和1溴丁烷的制备实验中,下列仪器最不可能用到的是________(填字母)。
a.圆底烧瓶 b.量筒 c.锥形瓶 d.布氏漏斗
(2)溴代烃的水溶性________(填“大于”、“等于”或“小于”)相应的醇,其原因是______________________________________________________________。
(3)将1溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在________(填“上层”“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的是________(填字母)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)欲除去溴乙烷中的少量杂质Br2,下列物质中最适合的是________(填字母)。
a.NaI b.NaOH c.NaHSO3 d.KCl
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于___________________,但在制备1溴丁烷时却不能边反应边蒸出产物,其原因是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com