
分析 (1)储热材料必须满足的特点是熔点低,易液化,且无毒;
(2)根据流程图可知,石膏悬浊液中加入碳酸铵溶液后过滤,得到碳酸钙与硫酸铵;CaSO4微溶且为悬浊液、CaCO3不溶,所以二者在离子方程式中均不拆;然后配平即可;
(3)氨碱法:以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱,工艺中产生大量CaCl2的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;△\;}}{\;}$2NH3↑+CaCl2+2H2O.
解答 解:(1)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,主要是利用无毒,熔点较低的性质,与导电性、溶解性无关,故答案为:ad;
(2)根据流程图可知,石膏悬浊液中加入碳酸铵溶液后过滤得到碳酸钙与硫酸铵,离子方程式为Ca2++CO32-=CaCO3↓,过滤操作后溶液中往往混有(NH4)2CO3,检验该溶液中是否含有CO32-的方法是:向溶液中加入稀盐酸,如果有能使石灰水变浑浊的气体生成,则溶液中含CO32-.答案为:Ca2++CO32-=CaCO3↓;过滤;向溶液中加入稀盐酸,如果有能使石灰水变浑浊的气体生成,则溶液中含CO32-.
(3)氨碱法工艺中产生大量CaCl2是由氯化铵和消石灰在加热条件下反应后生成氨气和氯化钙的反应,反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;△\;}}{\;}$2NH3↑+CaCl2+2H2O,故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;△\;}}{\;}$2NH3↑+CaCl2+2H2O.
点评 本题考查“氨碱法”和“联合制碱法”两种工艺的实验设计,掌握反应的原理是解题的关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | HCHO、Al2O3均含有氧元素,属于氧化物 | |
| B. | H2SO4、HNO3均为强酸,属于强电解质 | |
| C. | 蓝宝石、明矾的主要成分都是含有铝元素的氧化物 | |
| D. | AlCl3、Na2O2都属于离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石油的裂解可以提高汽油等轻质油的质量和产量 | |
| B. | 在一定条件下煤和氢气作用得到液体燃料的过程是煤的液化途径之一 | |
| C. | 葡萄糖、淀粉、油脂在一定条件下都能发生水解反应 | |
| D. | 往蛋白质溶液中加入饱和硫酸铵溶液,产生的沉淀再加水又可溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
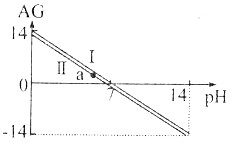
| A. | AG与pH的关系一定是AG=14-2pH | |
| B. | 直线Ⅰ和Ⅱ是因溶液的温度不同引起的,且T(Ⅰ)>T(Ⅱ) | |
| C. | AG=0时,溶液一定呈中性 | |
| D. | a点的溶液中可以有大量Na+、Cl-、Fe3+存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
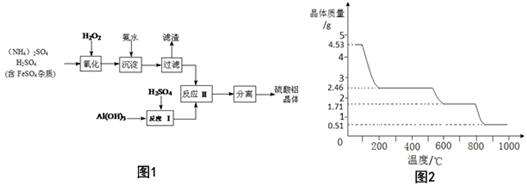
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com