
分析 (1)设出硫酸和盐酸的浓度,然后根据氢氧化钡的物质的量列式计算;
(2)分别根据n=cV计算出溶液中含有钡离子、硫酸根离子的物质的量,然后根据反应SO42-+Ba2+=BaSO4↓判断过量情况,根据不足量计算出生成沉淀的物质的量,最后根据m=nM计算出生成沉淀的质量.
解答 解:(1)设盐酸和硫酸的浓度都为x,100mL 3.0mol•L-1的Ba(OH)2溶液中含有氢氧根离子的物质的量为:3.0mol/L×0.1L×2=0.6mol,
加入0.6mol氢氧根离子时溶液为中性,则混合酸中氢离子总物质的量为0.6mol,即:(x+2x)×0.1L=0.6mol,解得:x=2.0mol/L,
则原混合液中氢离子的物质的量浓度为:2.0mol/L+2.0mol/L×2=6.0mol/L,
故答案为:6.0;
(2)75mL 3.0mo/L的氢氧化钡溶液中含有钡离子的物质的量为:3.0mol/L×0.075L=0.225mol,
原混合液中含有硫酸根离子的物质的量为:2.0mol/L×0.1L=0.2mol,
根据反应SO42-+Ba2+=BaSO4↓可知,钡离子过量,硫酸根离子不足,则反应生成硫酸钡的物质的量为0.2mol,质量为:233g/mol×0.2mol=46.6g,
故答案为:46.6.
点评 本题考查了混合物反应的计算、物质的量浓度的计算,题目难度中等,明确发生反应的实质为解答关键,(2)为易错点,注意先判断过量情况,然后根据不足量计算出生成沉淀的量,试题培养了学生的分析能力及化学计算能力.


 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
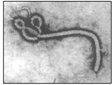 “埃博拉”病毒的形状宛如中国古代的“如意”(如图).病毒的基本化学组成是核酸和蛋白质.有的病毒还含有脂质、糖类等其他组分.下列有关有机物的说法不正确的是( )
“埃博拉”病毒的形状宛如中国古代的“如意”(如图).病毒的基本化学组成是核酸和蛋白质.有的病毒还含有脂质、糖类等其他组分.下列有关有机物的说法不正确的是( )| A. | 漂白粉、双氧水都可以杀灭埃博拉病毒 | |
| B. | 组成病毒的糖类、酯类和蛋白质在一定条件下都可发生水解反应 | |
| C. | 酯在酸性条件下的水解反应属于取代反应,也属于可逆反应 | |
| D. | 糖类和蛋白质的燃烧产物不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
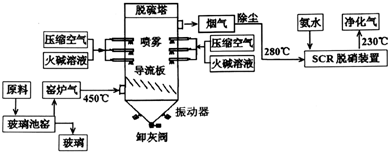
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘单质的升华过程中,只需克服分子间作用力 | |
| B. | NH4Cl属于离子化合物,该物质中只存在离子键 | |
| C. | 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成 | |
| D. | 金刚石和足球烯(C60)均为原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
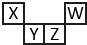 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍.下列判断不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍.下列判断不正确的是( )| A. | 最高正化合价:X<Y<Z | |
| B. | 原子半径:X<Y<Z | |
| C. | 气态氢化物的热稳定性:Z<W | |
| D. | 最高价氧化物对应水化物的酸性:X<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
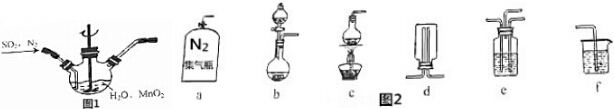
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的化学式为Fe2O3 | |
| B. | x=6 | |
| C. | 1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为$\frac{1}{3}$mol | |
| D. | 每生成1mol Y,反应转移的电子总数为4mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com