
有A、B、C、D、E、F、G、H、I九种常见物质,它们的转化关系(反应条件未注明)如图所示。常温下A为液态,D为固态,B、C、E、G为气态(C可以使带火星木条复燃),其中B、C、D为单质,F为淡黄色粉末状化合物,I的焰色反应为黄色。
请回答:(1)写出F的电子式 。(2)G的结构式是 。
(3)反应④是 反应(填“吸热”或者“放热”)
(4)写出反应⑤的化学反应方程式
(5)B、C单质已被应用于字宙飞船的燃料电池中,如图所示。若将B换成甲烷也能组成燃料电池(两个电极均由多孔性碳构成),该电池工作时: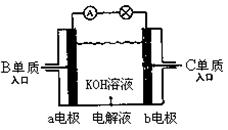
①b电极附近溶液的pH将 (填“增大”“减小”“不变”);
②a电极上的电极反应式为: 。
(6)在标准状况下,若将3.36L气体G通入50mL 4mol/L的H溶液中,用一个离子方程式表示其过程:
(每空2分,共14分)(1) 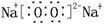 (2)O=C=O(3)吸热
(2)O=C=O(3)吸热
(4)2Na2O2+2H2O=4NaOH+O2 ↑ (5)①增大;② CH4+10OH--8e-=CO32-+7H2O
(6)4OH-+3CO2=H2O+CO32-+2HCO3-
解析试题分析:常温下A为液态,则A可能是水。F为淡黄色粉末状化合物,所以F水过氧化钠。水和过氧化钠反应生成氢氧化钠和氧气,C为气态,因此C是氧气,F水氢氧化钠。G是气态,也能和过氧化钠反应生成氧气,则G是CO2,I是碳酸钠。C和B反应生成水,则B是氢气。D为固态,能和氧气反应生成CO2,所以D是碳。碳和CO2反应生成CO,即E是CO。高温下碳和水蒸气反应生成氢气和CO。
(1)过氧化钠的电子式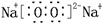 。
。
(2)CO2的结构式是O=C=O。
(3)碳和CO2反应是吸热反应,即反应④是吸热反应。
(4)反应⑤的化学反应方程式2Na2O2+2H2O=4NaOH+O2 ↑。
(5)①b电极通入氧气,所以b电极是正极,氧气得到电子,发生还原反应,电极反应式是O2+4e-+H2O=4OH-,所以b电极附近溶液的pH将增大。
②甲烷在负极通入,失去电子,发生氧化反应,则a电极上的电极反应式为CH4+10OH--8e-=CO32-+7H2O。
(6)3.36L气体CO2的物质的量是3.36L÷22.4L/mol=0.15mol,氢氧化钠的物质的量是0.05L×4mol/L=0.2mol,所以生成物是碳酸氢钠和碳酸钠。由于CO2和氢氧化钠的物质的量之比是3:4,所以该反应的离子方程式是4OH-+3CO2=H2O+CO32-+2HCO3-。
考点:考查无机框图题的有关判断、原电池的有关应用
点评:该题是中等难度的试题,试题综合性强,对学生的思维能力要求高,有利于培养学生的逻辑推理能力和发散思维能力。该类试题需要注意的是化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:填空题
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素在 C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素的原子结构示意图为 。
②该金属元素的单质与某红色氧化物在高温下反应,可用于焊接铁轨及定向爆破,已知:1mol该单质完全反应,当温度恢复至298K时,共放热QkJ,请写出该反应的热化学反应方程式为 。
(2)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①用化学方程式表明B溶液呈碱性的原因 。
②自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y是短周期同主族元素,Z是过渡元素,化合物Z2X、Z2Y可发生如下转化。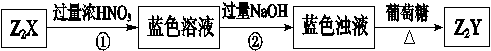
(1)X的元素符号为_______,Z2Y的化学式为_______。
(2)蓝色溶液中含有的阴离子是 。
(3)过程②中发生反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
构建知识网络是学习化学的重要方法。下列物质的转化网络可以概括几类反应,其中A、B、D、E、M、N、X、Y均表示一种中学化学中常见的无机物,反应②、③、④、⑤
的生成物可以是一种或几种。请回答下列问题: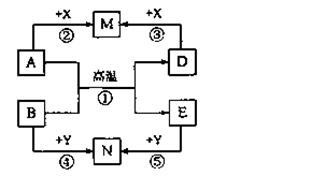
(1)A为固态非金属单质时,若反应①用于生产半导体材料,则M为________ Y为 。
(2)A为金属单质时,若M为NaAlO2溶液,N为棕黄色溶液,反应⑤的离子方程式是 。
(3)反应①在常温下进行时,也有很多组物质符合网络图中的转化关系,请列举一例(要求反应①中只有一种元素的化合价发生变化):A、B的化学式分别是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
物质的转化关系如下图所示(有的反应可能在水溶液中进行).其中甲为淡黄色固体化合物,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化,用两根玻璃棒分别蘸取化合物A、G的浓溶液并使它们接近,有大量白烟生成.请回答下列问题: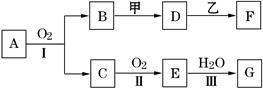
请回答些列问题:
(1)写出甲的电子式是 .
(2)写出反应Ⅰ的化学方程式 .
(3)A溶于水得到得到溶液X,在25℃下,将a mol·L-1的X与b mol·L-1的G溶液等体积混合,溶液显中性,则所得溶液中离子浓度由大到小的顺序为 用含a和b的代数式表示出该混合溶液中X的电离平衡常数 .
(4)工业上采用的一种污水处理方法是:保持污水的pH在5.0-6.0之间,通过如图装置处理污水.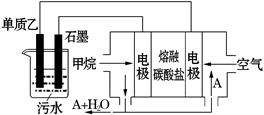
①电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:Ⅰ. ;Ⅱ. .
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图).A物质的化学式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
除去下列物质中所含的杂质,选用的试剂正确的是( )
| 选项 | 物质(杂质) | 试剂 |
| A | Al2O3(SiO2) | NaOH溶液 |
| B | CO2(SO2) | Na2CO3溶液 |
| C | FeCl2溶液(FeCl3) | Fe粉 |
| D | NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应中,反应后固体物质增重的是
| A.乙醇蒸气通过灼热的CuO粉末 | B.二氧化碳通过Na2O2粉末 |
| C.铝与V2O5发生铝热反应 | D.将锌粒投入Cu(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有下列六种转化途径,某些反应条件和产物已省略,下列有关说法正确的是 
| A.由途径①和②分别制取1molFeCl2,理论上各消耗1molFe,各转移2mole- |
| B.由途径③和④分别制取1 mol Na2SO4,理论上各消耗1 mol Cl2,各转移2mol e- |
| C.由途径⑤和⑥分别制取1 mol H2SO4,理论上各消耗1mol S,各转移6mol e- |
| D.以上说法都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
两种盐的固体混合物:①加热时有气体产生,②加水溶解时有沉淀生成,且沉淀溶于稀盐酸。满足上述条件的混合物是
| A.BaCl2和(NH4)2SO4 | B.AgNO3和NH4Cl |
| C.FeCl3和NaHCO3 | D.KCl和Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com