(Ⅰ)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大.W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z
2O和黑色的ZO两种氧化物.
(1)W位于元素周期表第
二
二
周期第
ⅤA
ⅤA
族.
W的气态氢化物稳定性比H
2O(g)
弱
弱
(填“强”或“弱”).
(2)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
2H
2SO
4(浓)+Cu
CuSO
4+SO
2↑+2H
2O
2H
2SO
4(浓)+Cu
CuSO
4+SO
2↑+2H
2O
.
(3)
Fe(s)+O2(g)=FeO(s)△H+-272.0KJ?mol
-1
2X(s)+O2(g)=x2o3(s)△H=-1675.7KJ?mol
-1
X的单质和FeO反应的热化学方程式是
Al(S)+FeO(S)+
O
2 (g)=
Al
2O
3(S)+Fe(S)△H=-565.85KJ/mol
Al(S)+FeO(S)+
O
2 (g)=
Al
2O
3(S)+Fe(S)△H=-565.85KJ/mol
.
(Ⅱ)已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X
2Y
3,Z元素可以形成负一价离子.请回答下列问题:
(1)X元素原子基态时的电子排布式为
1s22s22p63s23p63d104s24p3
1s22s22p63s23p63d104s24p3
(2)Y元素原子的价层电子的轨道表示式为
_
(3)X与Z可形成化合物XZ
3,该化合物的空间构型为
三角锥形
三角锥形
(4)已知化合物X
2Y
3在稀硫酸溶液中可被金属锌还原为XZ
3,产物还有ZnSO
4和H
2O,该反应的化学方程式是
As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O
As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O
.

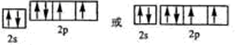
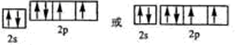
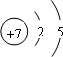 ,电子层数等于其周期数,最外层电子数等于其主族序数,所以氮元素属于第二周期第ⅤA族;
,电子层数等于其周期数,最外层电子数等于其主族序数,所以氮元素属于第二周期第ⅤA族;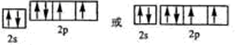 ,故答案为:
,故答案为: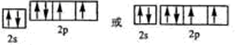 ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.(以下答案的W、X、Y、Z必须用相应的元素符号代替)
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.(以下答案的W、X、Y、Z必须用相应的元素符号代替)
