
【题目】Ⅰ.(1)在一定条件下,CH4可与NOx反应除去NOx,已知下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0kJ·mol-1
2NO2(g) △H=+67.0kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0kJ·mol-1
则CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g) △H=_________kJ·mol-1;
CO2(g)+2H2O(g)+N2(g) △H=_________kJ·mol-1;
(2)哈伯因证实N2、H2在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖。若用![]() 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:

①吸附后,能量状态最低的是 (填字母序号)。
②由上述原理,在铁表面进行NH3的分解实验,发现分解速率与浓度关系如图。
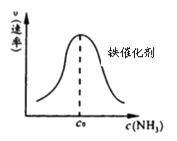
从吸附和解吸过程分析,c0前速率增加的原因可能是 ;c0后速率降低的原因可能是 。
Ⅱ.用石墨作电极电解下列溶液:
①稀H2SO4②K2SO4溶液 ③NaCl溶液 ④CuSO4溶液 ⑤KOH溶液
(1)阴极、阳极都有气体产生,其中溶液pH变大的是______________。(填序号)
(2)已知400mL 0.5 mol·L-1 CuSO4溶液,电解一段时间后,两极产生的气体体积相同,其阳极的电极反应式是_________________,两极共产生气体______________ mol,如要将溶液恢复原浓度,需要加入的物质为______________。
【答案】Ⅰ.(1)—875.3(2)①C;(1分)②氨的浓度增加,催化剂表面吸附的氨分子增多,速率增大,达到一定浓度后,氨分子浓度太大阻碍N2和H2的解吸。
Ⅱ.(1)③⑤(2)4OH--4e-=2H2O+O2↑;0.4;CuO和水(其他答案合理给分)
【解析】
试题分析:Ⅰ.(1)①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g)△H=+67.0kJ·mol-1
2NO2(g)△H=+67.0kJ·mol-1
③H2O(g)=H2O(l)△H=-41.0kJ·mol-1
根据盖斯定律可知①-②-③×2可得:CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g)
CO2(g)+2H2O(g)+N2(g)
△H=(-890.3-67.0+41.0×2)kJ·mol-1=—875.3kJ·mol-1;
(2)①由于化学键的断裂要吸收能量,故活化状态B的能量高于初始状态A的能量,而此反应为放热反应,故初始状态A的能量高于末态C的能量,故C的能量最低;②c0前氨的浓度增加,导致反应速率加快;c0后由于氨分子浓度太大阻碍N2和H2的解吸,故反应速率减慢;
Ⅱ.(1)由给出电解质溶液可知,阴阳极都有气体产生,实质是(ⅰ)电解的水生成氧气与氢气,电解质溶液应为:①稀H2SO4、②K2SO4溶液、⑤KOH溶液.电解后溶液的浓度增大,①稀H2SO4电解后溶液的酸性增强,溶液PH值不变,②K2SO4溶液是中性溶液,电解后溶液PH值不变,⑤KOH溶液电解后溶液的碱性增强,溶液PH值增大;(ⅱ)电解③NaCl溶液,生成氢气和氯气,同时生成NaOH溶液,溶液的pH增大,故答案为③⑤;
(2)400mL 0.5 mol·L-1 CuSO4溶液中CuSO4的物质的量为0.2mol,最初电解时生成铜和氧气,电极反应式为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,完全电解生成的O2为0.1mol,继续电解时生成氢气和氧气,根据电子守恒规律,两极产生的气体体积相同时,H2和氧气的物质的量均为0.2mol,共产生气体的物质的量为0.4mol;根据电解什么,补什么的原则,可以添加0.2molCuO和0.2molH2O即可恢复原浓度,也可以添加0.2molCu(OH)2达到相同效果。
2Cu+O2↑+2H2SO4,完全电解生成的O2为0.1mol,继续电解时生成氢气和氧气,根据电子守恒规律,两极产生的气体体积相同时,H2和氧气的物质的量均为0.2mol,共产生气体的物质的量为0.4mol;根据电解什么,补什么的原则,可以添加0.2molCuO和0.2molH2O即可恢复原浓度,也可以添加0.2molCu(OH)2达到相同效果。


科目:高中化学 来源: 题型:
【题目】下列有关仪器的使用正确的是( )
A. 手持试管给试管内的物质加热
B. 用燃着的酒精灯去点燃另一盏酒精灯
C. 用天平称量药品时用手直接拿砝码
D. 用滴管滴加液体时滴管应垂直悬垂在容器上方且不能触及容器内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.过滤时为加快速度,可先将上层清液注入过滤器中,再将沉淀转移到过滤器中
B.蒸发时用玻璃棒搅拌,是为了使析出的固体重新溶解
C.蒸馏时需从冷凝管上口进水,下口出水
D.分液时,下层液体放完后,再从下口放出上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )
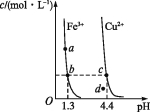
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
C.加适量NH4Cl固体可使溶液由a点变到b点
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3S+6KOH ![]() 2K2S+K2SO3+3H2O,下列说法正确的是
2K2S+K2SO3+3H2O,下列说法正确的是
A. S是氧化剂,KOH是还原剂 B. 若3mol硫完全反应,则反应中共转移了4mol电子 C. 还原剂与氧化剂的质量比是2:1 D. 氧化产物和还原产物的物质的量之比为3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知液氨的性质与水相似,25 ℃时,NH3+NH3![]() NH4++ NH2-, NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是( )
NH4++ NH2-, NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是( )
A.在液氨中加入NaNH2可使液氨的离子积变大
B.在液氨中加入NH4Cl可使液氨的离子积减小
C.在此温度下液氨的离子积为1×10-30
D.在液氨中放入金属钠,可生成NaNH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期元素。已知A、B、E三原子最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水;C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。请回答下列问题:
(1)写出:B的元素符号________________,D的原子结构示意图_____________________,E的最高价含氧酸的化学式_______________________。
(2) E元素+1价含氧酸的电子式为:_________________。
(3)写出A、B两元素最高价氧化物对应的水化物相互反应的化学方程式
__________________________________________________。
(4) D、E最高价氧化物对应水化物的酸性较弱为_________________。(用化学式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,短周期元素R所形成的离子![]() 与R2可发生如下反应:
与R2可发生如下反应: ![]() +2R2+6H+==3R+3H2O,下列关于元素R的叙述中一定正确的是( )
+2R2+6H+==3R+3H2O,下列关于元素R的叙述中一定正确的是( )
A. R原子的最外层上可能有4个电子
B. ![]() 中的R只能被还原
中的R只能被还原
C. R可能是碳元素
D. R最高价氧化物对应水化物为强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com