
| A. | 采用酸碱中和滴定法测定 | |
| B. | 与足量Zn反应,测量生成的H2体积 | |
| C. | 与足量AgNO3溶液反应,称量生成的AgCl质量 | |
| D. | 与足量CaCO3反应,测量生成的CO2质量 |
分析 A.中和滴定能测出酸的物质的量;
B.根据氢气的体积可求出氢气的物质的量;
C.残余液中的MnCl2也会与AgNO3反应形成沉淀;
D.盐酸与足量CaCO3反应生成二氧化碳.
解答 解:A.中和滴定能测出酸的物质的量,然后求出酸的浓度,故A正确;
B.根据氢气的体积可求出氢气的物质的量,然后求出酸的物质的量,故B正确;
C.与足量AgNO3溶液反应,称量生成的AgCl质量,加入足量的硝酸银溶液只能求出氯离子的量,而不能求出剩余盐酸的浓度,故C错误;
D.盐酸与足量CaCO3反应生成二氧化碳,根据CO2质量可求出酸的物质的量,故D正确.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,侧重实验基本操作和实验原理的考查,注意实验原理及实验的操作性、评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ=Ⅱ | |
| B. | 若X、Y均为气态,则平衡时气体X的转化率:Ⅰ>Ⅱ | |
| C. | 若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间不相同 | |
| D. | 平衡时Ⅰ容器的体积小于VL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层只有1个电子的元素一定是金属元素 | |
| B. | 最外层只有2个电子的元素一定是金属元素 | |
| C. | 原子核外各层电子数相等的元素不一定是金属元素 | |
| D. | 核电荷数为17的元素的原子易获得1个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
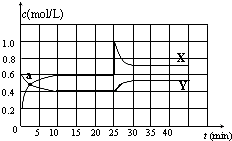 已知NO2和N2O4可以相互转化:N2O4(g)?2NO2(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
已知NO2和N2O4可以相互转化:N2O4(g)?2NO2(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )| A. | 图中的两条曲线,X是表示NO2浓度随时间的变化曲线 | |
| B. | a点时v(N2O4)=v(NO2) | |
| C. | 25min时改变了影响速率的一个因素,使得NO2转变为N2O4,该改变是将密闭容器的体积缩小,增大压强 | |
| D. | 前10min内用v(N2O4)表示的化学反应速率为0.02 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2(g)+0.5O2(g)?SO3(g)△H=-213kJ•mol-1 说明25℃,101kPa下,lmolSO2与0.5mol氧气放入密闭容器中生成SO3时放出213 kJ热量 | |
| B. | 若反应物总能量高于生成物总能量,反应放热,△H<0 | |
| C. | 化学反应必然伴随能量变化 | |
| D. | 酸和碱的中和反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核外电子层数相同 | B. | 半径大小顺序Na+<Mg2+<Al3+ | ||
| C. | 核外电子数相同 | D. | 最外层电子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着经济的发展和生活水平的提高,近年来我省汽车拥有量呈较快增长趋势.
随着经济的发展和生活水平的提高,近年来我省汽车拥有量呈较快增长趋势.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验目的 | |
| A | 向NaBr溶液中滴加新制氯水 | 比较Cl2与Br2的氧化性强弱 |
| B | 用同一电路分别测定盐酸和某一元酸溶液的导电性 | 比较盐酸和该一元酸酸性的强弱 |
| C | 分别向AlCl3溶液和MgCl2溶液中加入过量NaOH溶液 | 比较镁与铝的金属性强弱 |
| D | 常温下测定同浓度Na2CO3溶液和Na2SO4溶液的pH值 | 比较硫和碳的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石为网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| B. | 氯化钠晶体中,每个Na+周围距离相等的Na+共有12个 | |
| C. | 金属钾的晶胞空间利用率大于金属钋的晶胞空间利用率 | |
| D. | 金属铜属于六方最密堆积结构,金属镁属于面心立方最密堆积结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com