
【题目】已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示。
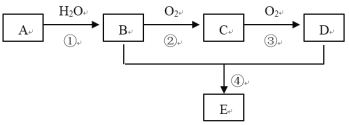
请回答下列问题:
(1)写出A的电子式 ___________。
(2)B、D分子中官能团的名称是 ___________。
(3)写出下列反应的化学方程式:
①________________;
②_________________;
④___________________,反应类型:_______。
(4)物质B可以被直接氧化为D,需要加入的试剂是___________。
【答案】![]() 羟基/羧基 CH2=CH2+H2O
羟基/羧基 CH2=CH2+H2O![]() CH3CH2OH 2CH3CH2OH+O2
CH3CH2OH 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3COOH+CH3CH2OH
2CH3CHO+2H2O CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 取代反应或酯化反应 酸性高锰酸钾溶液或酸性重铬酸钾溶液
CH3COOCH2CH3+H2O 取代反应或酯化反应 酸性高锰酸钾溶液或酸性重铬酸钾溶液
【解析】
A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,A和水发生加成反应生成B为CH3CH2OH,B被氧化生成C为CH3CHO,C被氧化生成D为CH3COOH,E是具有果香味的物质,且B和D发生酯化反应生成E,因此E为CH3COOCH2CH3。据此解答。
(1)乙烯分子中含有共价键,电子式为![]() ;
;
(2)乙醇分子中含有羟基,乙酸分子中羧基;
(3) 根据以上分析可知反应①是乙烯与水的加成反应,方程式为CH2=CH2+H2O![]() CH3CH2OH;反应②是乙醇的催化氧化,方程式为2CH3CH2OH+O2
CH3CH2OH;反应②是乙醇的催化氧化,方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
反应④是酯化反应,方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,反应类型为取代反应或酯化反应;
CH3COOCH2CH3+H2O,反应类型为取代反应或酯化反应;
(4) 酸性高锰酸钾溶液或酸性重铬酸钾溶具有较强的氧化性,可以直接把乙醇氧化为乙酸。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法中正确的是
A.46gNO2和N2O4的混合气体中含有的原子个数为3NA
B.常温常压下,17gNH3含有NA个N-H共价键
C.1molFe与S恰好完全反应,转移的电子数为3NA
D.标况下,2.24LH2O含有的质子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是重要的化工原料,可以制得多种有机制品。用乙炔为原料制备PI(聚异戊二烯)的流程如图:
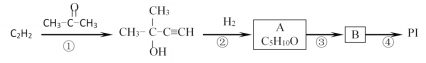
(1)有机物A中官能团的名称___,反应③的反应条件____。
(2)若将①中反应物“![]() ”改为“乙醛”,经过②③④后得到产物的结构简式是__。
”改为“乙醛”,经过②③④后得到产物的结构简式是__。
乙炔在一定条件下还可合成PVB塑料(聚乙烯醇缩丁醛):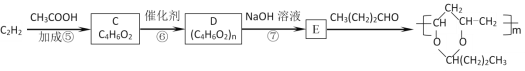
已知:-CHO+ +H2O
+H2O
(3)写出C的结构简式为__;2分子乙炔也能发生加成反应得到链烃,其反应产物的结构简式为___。
(4)反应⑦的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,工业上采用氨催化氧化法制备,生产过程中发生的反应有:
NH3(g)+![]() O2(g)
O2(g)![]() NO(g)+
NO(g)+![]() H2O(l) △H1= -292.3kJ/mol
H2O(l) △H1= -292.3kJ/mol
NO(g)+![]() O2(g)= NO2(g) △H2= -57.1kJ/mol
O2(g)= NO2(g) △H2= -57.1kJ/mol
3NO2(g)+ H2O(l)=2HNO3(aq)+NO(g) △H3= -71.7kJ/mol
回答以下问题:
(1) NH3(g)+2O2(g)=HNO3(aq)+ H2O(l) 的 △H= ___________ kJ/mol。原料气体(NH3、O2)在进入反应装置之前,必须进行脱硫处理。其原因是____。
(2)研究表明2NO(g)+ O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
(a)2NO(g)![]() N2O2(g)(快) (b)N2O2(g)+ O2(g)
N2O2(g)(快) (b)N2O2(g)+ O2(g)![]() 2NO2(g)(慢)
2NO2(g)(慢)
①该反应的速率由b步决定,说明b步反应的活化能比a步的 ___(填“大”或“小”)。
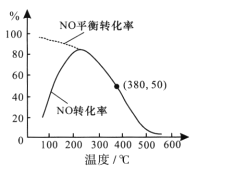
②在恒容条件下,NO和O2的起始浓度之比为2:1,反应经历相同时间,测得不同温度下NO转化为NO2的转化率如图,则150℃时,v正___ v逆(填“>”或“<”)。若起始c(O2)=5.0×10-4mol/L,则380℃下反应达平衡时c(O2)=____mol/L。
(3) T1温度时,在容积为2L的恒容密闭容器中发生反应2NO+ O2![]() 2NO2,实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如下图所示:
2NO2,实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如下图所示:
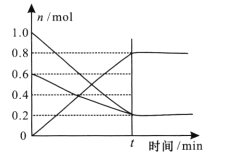
①下列说法能表明该反应已经达到平衡状态的是 ____填序号)
A. 混合气体的密度不变 B. 混合气体的颜色不变
C. k正、k逆不变 D. 2v正(O2)=v逆(NO2)
②化学平衡常数K与速率常数k正、k逆的数学关系式K=____。
③温度为T1时的化学平衡常数K= _____。若将容器的温度变为T2时,k正=k逆,则T2 ___T1(填“>
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是
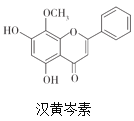
A. 能与Na2CO3溶液反应放出气体
B. 该物质遇FeCl3溶液不显色
C. 1mol该物质与溴水反应,最多消耗2molBr2
D. 与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白:
(1)写出表示含有6个质子、8个中子的原子的化学符号:________,该同位素原子在科学研究中有着重要的用途,该用途是_____________
(2)原子序数为113的元素在元素周期表中的位置________。
(3)在![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中有_______种核素
中有_______种核素
(4)在自然界中许多元素有多种核素,如氧元素存在![]() 、
、![]() 、
、![]() 三种核素,氢元素有
三种核素,氢元素有![]() 、
、 ![]() 、
、![]() 三种核素。
三种核素。
①![]() 、
、![]() 、
、![]() 、
、![]() 四种核数最多可以组成______种水分子
四种核数最多可以组成______种水分子
②请画出![]() 微粒的结构示意图:__________________。
微粒的结构示意图:__________________。
③现有11g由![]() 和
和![]() 组成的水分子,其中含中子数为_____mol,电子数为______个。
组成的水分子,其中含中子数为_____mol,电子数为______个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式书写不正确的是
A. 用FeCl3溶液腐蚀印刷线路板上的Cu:2Fe3++Cu=2Fe2++Cu2+
B. 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
C. 稀硝酸中加入过量铁粉: Fe+4H++NO3-=Fe3++NO↑+2H2O
D. 用Na2CO3溶液浸泡锅炉水垢:CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)
CaCO3(s)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难溶性杂卤石(K2SO4MgSO42CaSO42H2O)在水中存在如下平衡K2SO4MgSO42CaSO42H2O (s)![]() 2Ca2++2K++ Mg2++4SO42-+2H2O,为能充分利用钾资源,用足量的饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾。工艺流程是:首先需要溶浸与分离,见下图:
2Ca2++2K++ Mg2++4SO42-+2H2O,为能充分利用钾资源,用足量的饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾。工艺流程是:首先需要溶浸与分离,见下图:

(1)不同温度下,K+的浸出浓度与溶浸时间的关系如下图,由图可得,随着温度升高①________________;②______________。

(2)为了提高浸出效率,可采取的措施是:________;过滤用到的玻璃仪器名称是:______。
(3)滤渣主要成分有_________和_________以及未溶杂卤石,用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石、浸出K+的原因: _________________________________。
(4) 溶浸与分离过滤后,滤液中的主要杂质离子是______,进一步“除杂”环节见下图。可先加入______溶液,经搅拌等操作后,过滤,再加入_________溶液调滤液pH至中性。

(5)中过滤得到的母液中含有大量的_____(填写化学式),检验其中溶质阴离子的方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)在化学合成上用作还原剂及催化剂。工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为________(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为_______(填>、<、=)40%。
(2)将111.2g绿矾(FeSO47H2O,式量为278)在高温下加热,充分反应后生成Fe2O3固体和SO2、SO3、水的混合气体,则生成Fe2O3的质量为_______g;SO2为_______mol。实验室可用以下方法制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O,式量为392]。
(3)将4.88g铁屑(含Fe2O3)与25mL 3mol/L H2SO4充分反应后,得到FeSO4和H2SO4的混合溶液,稀释溶液至100mL,测得其pH=1。铁屑中Fe2O3的质量分数是________(保留两位小数)。
(4)向上述100mL溶液中加入与该溶液中FeSO4等物质的量的(NH4)2SO4晶体,待晶体完全溶解后蒸发掉部分水,冷却至t℃,析出摩尔盐晶体12.360g,剩余溶液的质量为82.560g。t℃时,计算(NH4)2SO4·FeSO4·6H2O的溶解度。_______(保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com