
| A. | 银镜反应采用水浴加热 | |
| B. | 用通过盛溴水的洗气瓶的方法除去甲烷气体中含有的乙烯杂质 | |
| C. | 在乙醛还原新制Cu(OH)2悬浊液的实验中,制Cu(OH)2悬浊液时应保持NaOH过量,可直接加热 | |
| D. | 配制银氨溶液时,将AgNO3溶液滴入氨水中 |
分析 A,银镜反应需要温度较低;
B.乙烯和溴发生加成反应生成1,2-二溴乙烷,甲烷和溴不反应;
C.乙醛和新制氢氧化铜悬浊液发生氧化反应必须在碱性条件下,且需要加热;
D.配制银氨溶液时,将氨水溶液滴入AgNO3中,且生成的沉淀恰好溶解为止.
解答 解:A.银镜反应是醛基与银氨离子的反应,如果温度过高,银氨络离子会与氢氧根反应得到氨,而不与醛基反应;温度过高,容易产生易爆物AgN3,容易发生爆炸危险;不论是化学镀镜,还是电化学镀镜,关键都是控制反应平稳、生成镀膜均匀水浴形成的环境,温度均匀,反应平稳,故A正确;
B.乙烯和溴发生加成反应生成1,2-二溴乙烷,甲烷和溴不反应,所以可以用溴水除去甲烷中的乙烯,故B正确;
C.醛和新制氢氧化铜悬浊液的反应必须在碱性条件下,所以氢氧化钠必须过量,且该反应需要加热,故C正确;
D.配制银氨溶液,必须是向AgNO3溶液中逐滴加入稀氨水(边滴边振荡)至沉淀恰好完全溶解(得澄清溶液),若将AgNO3溶液滴入氨水中,无法判断AgNO3与NH3•H2O恰好完全反应,故D错误;
故选D.
点评 本题考查化学实验方案评价,为高频考点,侧重考查溶液配制、除杂等知识点,明确物质性质及实验原理即可解答,注意银氨溶液配制方法,为易错点.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=0 的溶液中:Mg2+、Fe3+、NO3-、SO42- | |
| B. | 能和Ca2+生成沉淀的溶液中:Ba2+、K+、CH3COO-、Cl- | |
| C. | 能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、SO32- | |
| D. | 由水电离出的c(OH-)=1×10-13mol/L的溶液中:NH4+、Al3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH |  | 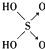 | 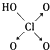 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
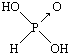 和
和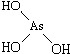 ,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性
,二者酸性强弱原因亚磷酸含有1个非羟基氧原子,而亚砷酸没有非羟基氧原子,故亚磷酸的酸性强于亚砷酸的酸性查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷的分子式是C3H6 | |
| B. | 丙烷分子中的碳原子在一条直线上 | |
| C. | 丙烷在光照条件下能够发生取代反应 | |
| D. | 丙烷的熔点比乙烷低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能含有共价键 | B. | 共价化合物中一定不含离子键 | ||
| C. | 离子化合物中肯定只含离子键 | D. | 共价化合物中含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
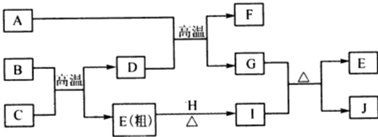
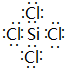 .
. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com