
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z所处的族序数是周期序数的2倍。下列判断不正确的是
![]()
A. 最高正化合价:X<Y<Z
B. 原子半径:X<Y<Z
C. 气态氢化物的热稳定性:Z<W
D. 最高价氧化物对应水化物的酸性:X<Z
【答案】B
【解析】
结合短周期元素X、Y、Z、W在元素周期表中的相对位置可知,X、W处于第二周期、Y、Z处于第三周期;Z所处的族序数是周期序数的2倍,则Z位于ⅥA族,为S元素,根据相对位置可知Y为P、X为C、W为F。
A、X、Y、Z分别为C、P、S元素,最高化合价分别为+4、+5、+6,则最高正化合价:X<Y<Z,故A正确;
B、X、Y、Z分别为C、P、S元素,电子层越多,原子半径越大,电子层相同时核电荷数越大,原子半径越小,则原子半径大小为:X<Z<Y,故B错误;
C、非金属性越强,气态氢化物越稳定,非金属性S<F,则气态氢化物的热稳定性:Z<W,故C正确;
D、X、Z分别为C、S元素,非金属性C<S,则最高价氧化物对应水化物的酸性:X<Z,故D正确;
故答案选B。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】现用17.10 g Ba(OH)2固体配成250mL溶液待用。利用上述所配制的溶液测定Na2SO4和NaHSO4混合物的组成。(计算结果保留三位有效数字)
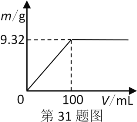
(1)配制的Ba(OH)2溶液的物质的量浓度_____mol·Lˉ1。
(2)现称取5.24g该固体混合物,配成100mL溶液。逐滴加入上述Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图。当产生沉淀最多时,混合溶液中c(OH-)为________mol·L-1(忽略体积变化)。
(3)混合物中n[Na2SO4]∶n(NaHSO4)为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)可逆反应A(g)+B(g)2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示.

①由T1向T2变化时,正反应速率________逆反应速率(填“>”、“<”或“=”).
②由T3向T4变化时,正反应速率________逆反应速率(填“>”、“<”或“=”).
③反应在________温度下达到平衡.
④此反应的正反应为________热反应.
(2)800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)2NO2(g),在反应体系中,n(NO)随时间的变化如表所示:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
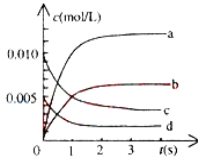
①图中表示NO2变化的曲线是________ ,用O2表示从0~2s内该反应的平均速率v=________ .
②能说明该反应已经达到平衡状态的是________
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O。

(1)甲池是______装置;
(2)乙池中A(石墨)电极的名称是______;
(3)写出通入CH3OH的电极的电极反应式:______;
(4)乙池中反应的化学方程式为______;
(5)当乙池中B(Ag)极的质量增加4.32g时,此时丙池某电极上析出1.60g某金属,则丙池中的某盐溶液可能是 ______(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,甲为0.1mol/L的醋酸溶液,乙为0.5mol/L的醋酸溶液。下列说法正确的是
A. 溶液的导电能力:甲=乙 B. 醋酸的电离转化率:甲 >乙
C. 对水的电离的抑制程度:甲 >乙 D. c(CH3COO-):甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知三氯化铁的熔点为306℃,沸点为315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组用如下装置制备三氯化铁,并探究SO2与三氯化铁反应的产物。

(1)以上A—F装置中需要加热的有___________(用字母表示)。
(2)F中碱石灰的作用是_________________________________。
(3)反应一段时间后熄灭酒精灯,关闭装置中的两个止水夹,冷却至室温。若将收集器中的三氯化铁配制成溶液,分液漏斗中的X物质是___________,操作过程为___________。
(4)将G中产生的二氧化硫气体通入到收集器的三氯化铁溶液中,取反应后的溶液进行如下实验:
实验I:向溶液中加入BaCl2溶液,出现白色沉淀,说明溶液中含有的离子是___________,产生这种离子的离子方程式为_________________________________。
实验II:取少量液体于试管中,用一束光照射液体,有一条光亮的通路,试用离子方程式解释以上现象:_________________________________。
(5)取少量D中反应后剩余固体于小烧杯中,再加入稀盐酸将固体溶解,向所得溶液中滴入几滴KSCN溶液,溶液未变红色,___________(填“能”或“不能”)说明D中无FeCl3,用离子方程式解释______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,把0.5mol/L的HF溶液加水稀释,随着加水量的增大,下列判断正确的是
A. 溶液中F-的个数减小 B. 电离平衡常数ka值变大
C. 电离转化率不变 D. c(F- )/c(HF)此比值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空:
(1)漂白粉溶液在空气中放置失效,发生反应的离子方程式:_______________________。
(2)次氯酸的电离方程式:______________________________________。
(3)氯化铁溶液与单质铜反应的化学方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A. AgCl>AgI>Ag2CrO4 B. AgCl>Ag2CrO4>AgI
C. Ag2CrO4>AgCl>AgI D. Ag2CrO4>AgI>AgCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com