
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源:辽宁省沈阳二中2011届高三第四次阶段测试化学试题 题型:058
Ⅰ.实验室有一瓶失去标签的某白色固体,已知其成份可能是碳酸或亚硫酸的钠盐或钾盐,且其成分单一.现某化学小组通过如下步骤来确定其成分:
(1)阳离子的确定:
实验方法及现象:________
结论:此白色固体是钠盐.
(2)阴离子的确定:
①取少量白色固体于试管中,然后向试管中加入稀盐酸,白色固体全部溶解,产生无色气体,此气体能使溴水褪色.
②要进一步确定其成分需补做如下实验:取适量白色固体配成溶液,取少许溶液于试管中,加入BaCl2溶液,出现白色沉淀.
Ⅱ.确认其成分后,由于某些原因,此白固体部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定变质固体中X的含量,具体步骤如下:
步骤Ⅰ称取样品1.000 g.
步骤Ⅱ将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀.
步骤Ⅲ移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01 mol·L-1 KMnO4标准溶液滴定至终点.
按上述操作方法再重复2次.
(1)写出步骤Ⅲ所发生反应的离子方程式________.
(2)在配制0.01 mol·L-1 KMnO4溶液时若仰视定容,则最终测得变质固体中X的含量________(填“偏大”、“偏小”或“无影响”)
(3)滴定结果如下表所示:

则该变质固体中X的质量分数为________.
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
I.实验室有一瓶失去标签的某白色固体,已知其成份可能是碳酸或亚硫酸的钠盐或钾盐,
且其成分单一。现某化学小组通过如下步骤来确定其成分:
⑴阳离子的确定:
实验方法及现象: 。
结论:此白色固体是钠盐。
⑵阴离子的确定:
①取少量白色固体于试管中,然后向试管中加入稀盐酸,白色固体全部溶解,产生无色气体,此气体能使溴水褪色。
②要进一步确定其成分需补做如下实验:取适量白色固体配成溶液,取少许溶液于试管中,加入BaCl2溶液,出现白色沉淀。
II.确认其成分后,由于某些原因,此白色固体部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定变质固体中X的含量,具体步骤如下:
步骤I 称取样品1.000 g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
⑴写出步骤III所发生反应的离子方程式 。
⑵在配制0.01 mol·L-1 KMnO4溶液时若仰视定容,则最终测得变质固体中X的含量 (填“偏大”、“偏小”或“无影响”)
⑶滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
则该变质固体中X的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
I.实验室有一瓶失去标签的某白色固体,已知其成份可能是碳酸或亚硫酸的钠盐或钾盐,
且其成分单一。现某化学小组通过如下步骤来确定其成分:
⑴阳离子的确定:
实验方法及现象: 。
结论:此白色固体是钠盐。
⑵阴离子的确定:
①取少量白色固体于试管中,然后向试管中加入稀盐酸,白色固体全部溶解,产生无色气体,此气体能使溴水褪色。
②要进一步确定其成分需补做如下实验:取适量白色固体配成溶液,取少许溶液于试管中,加入BaCl2溶液,出现白色沉淀。
II.确认其成分后,由于某些原因,此白色固体部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定变质固体中X的含量,具体步骤如下:
步骤I 称取样品1.000 g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
⑴写出步骤III所发生反应的离子方程式 。
⑵在配制0.01 mol·L-1 KMnO4溶液时若仰视定容,则最终测得变质固体中X的含量 (填“偏大”、“偏小”或“无影响”)
⑶滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
则该变质固体中X的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三百校大联考一模考试化学试卷 题型:实验题
(15分)氯酸钾是无机盐工业的重要产品之一,可通过反应:NaC1O3+KC1
KC1O3↓+NaC1制取。
(1)实验室制取氯酸钠可通过反应:3C12+6NaOH 5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。
5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。

(2)工业上制取氯酸钠采用在热的石灰乳通入氯气,然
后结晶除去氯化钙后,再加入一种钠盐,合适的钠盐是
。
(3)北美、欧洲国家生产氯酸钠用二级精制盐水。采用
无隔膜电解法获得,生产过程中涉及的主要的化学反应式如下:
总反应式:NaC1+3H2O NaC1O3+3H2↑
NaC1O3+3H2↑
阳极:2C1——2e—
C12↑阴极:2H2O+2e—
H2↑+2OH—
液相反应:C12+H2O HC1O+H++C1—
HC1O
HC1O+H++C1—
HC1O H++C1O—
H++C1O—
2HC1O+CO— C1O3—+2C1—+2H+
①
精制食盐水时,要除去其中的Ca2+、Mg2+及SO42—并得到中性溶液,依次加入的化学试剂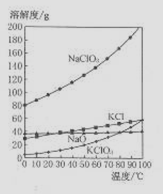
② 是 、 、 ;过滤,滤液中再加入适量的稀盐酸,得一级精制盐水再经离子交换处理或膜处理得到二级精制盐水。
②电解时,必须在食盐水中加入Na2Cr2O2,其目的是防止 (填离子符号)电解过程中在阴极上放电。
(4)若NaC1O2与KC1的混合溶液中NaC1O3与KC1的质量分数分别为0.290和0.203(相关物质的溶解度曲线如右图)。从混合溶液中获得较多KC1O3晶体的实验操作依次
为 (填操作名称)、干燥。
(5)样品中C1O3—的含量可用滴定法进行测定,实验步骤
如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:从上述容量瓶中取出10.00mL于锥形瓶中,准确加入25mL1000mol/L(NH4)2Fe(SO4)2。溶液(过量),加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:再在锥形瓶中加入100mL蒸馏水及某种氧化还原反应指示剂,用0.200mol/LK2Cr2O2标准溶液滴定至终点。
步骤4: 。
步骤5:数据处理与计算。
①步骤2,静置10min的目的是 。
②步骤3中K2Cr2O2标准溶液应盛放在 中(填仪器名称)。
③为了确定样品中C1O2—的质量分数,步骤4的操作内容是 。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省高三百校大联考一模考试化学试卷 题型:实验题
(15分)氯酸钾是无机盐工业的重要产品之一,可通过反应:NaC1O3+KC1 KC1O3↓+NaC1制取。
(1)实验室制取氯酸钠可通过反应:3C12+6NaOH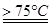 5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。
5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。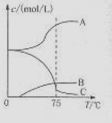
(2)工业上制取氯酸钠采用在热的石灰乳通入氯气,然
后结晶除去氯化钙后,再加入一种钠盐,合适的钠盐是
。
(3)北美、欧洲国家生产氯酸钠用二级精制盐水。采用
无隔膜电解法获得,生产过程中涉及的主要的化学反应式如下:
总反应式:NaC1+3H2O NaC1O3+3H2↑
NaC1O3+3H2↑
阳极:2C1——2e— C12↑阴极:2H2O+2e— H2↑+2OH—
液相反应:C12+H2O HC1O+H++C1— HC1O
HC1O+H++C1— HC1O H++C1O—
H++C1O—
2HC1O+CO— C1O3—+2C1—+2H+
精制食盐水时,要除去其中的Ca2+、Mg2+及SO42—并得到中性溶液,依次加入的化学试剂
是 、 、 ;过滤,滤液中再加入适量的稀盐酸,得一级精制盐水再经离子交换处理或膜处理得到二级精制盐水。
②电解时,必须在食盐水中加入Na2Cr2O7,其目的是防止 (填离子符号)电解过程中在阴极上放电。
(4)若NaC1O3与KC1的混合溶液中NaC1O3与KC1的质量分数分别为0.290和0.203(相关物质的溶解度曲线如右图)。从混合溶液中获得较多KC1O3晶体的实验操作依次
为 (填操作名称)、干燥。
(5)样品中C1O3—的含量可用滴定法进行测定,实验步骤
如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:从上述容量瓶中取出10.00mL于锥形瓶中,准确加入25mL1000mol/L(NH4)2Fe(SO4)2。溶液(过量),加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:再在锥形瓶中加入100mL蒸馏水及某种氧化还原反应指示剂,用0.200mol/LK2Cr2O7标准溶液滴定至终点。
步骤4: 。
步骤5:数据处理与计算。
①步骤2,静置10min的目的是 。
②步骤3中K2Cr2O2标准溶液应盛放在 中(填仪器名称)。
③为了确定样品中C1O3—的质量分数,步骤4的操作内容是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com