
【题目】铋(Bi)位于元素周期表中VA族,其价态为+3时较稳定,铋酸钠(NaBiO3)溶液呈无色。现取一定量的硫酸锰(MnSO4)溶液,向其中依次滴加下列溶液,对应的现象如表所示:

则NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为( )
A. I2、H2O2、KMnO4、NaBiO3B. H2O2、I2、NaBiO3、KMnO4
C. NaBiO3、KMnO4、H2O2、I2D. KMnO4、NaBiO3、I2、H2O2
【答案】C
【解析】
根据发生的反应中,氧化剂的氧化性大于氧化产物的氧化性这一规律来回答判断。
铋酸钠(NaBiO3)溶液呈无色,硫酸锰(MnSO4)溶液,溶液显紫色,则NaBiO3(氧化剂)的氧化性强于KMnO4(氧化产物)的氧化性;
由②中现象可知:KMnO4氧化H2O2产生O2,自身被还原为Mn2+,则KMnO4(氧化剂)的氧化性强于H2O2(氧化产物)的氧化性;
由③中现象可知:碘离子被双氧水氧化成单质碘,则双氧水(氧化剂)的氧化性强于碘单质(氧化产物)的氧化性,
综上所述,NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序是:NaBiO3>KMnO4>H2O2>I2,故C正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】室温下向10mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液,pH的变化曲线如图所示。下列说法不正确的是
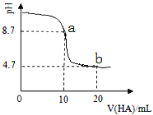
A. pH=4.7时,2c(Na+) = c(A-)+ c(HA)
B. 一元酸HA为弱酸
C. a、b两点所示溶液中水的电离程度不同,且a点比b点电离程度大
D. a点所示溶液中c(A-)>c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子形式存在(Cl2可与碘离子反应生成碘单质)。实验室从海藻中提取碘的流程如下:
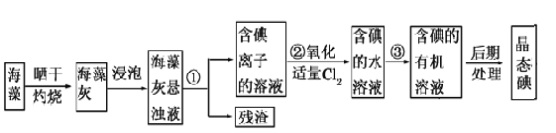
(1)指出提取碘的过程中有关实验操作的名称:③______;
(2)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有漏斗、烧杯、玻璃棒、 集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持装置、物品,尚缺少的玻璃仪器是_______。
(3)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出图中所示的实验装置中的错误之处:
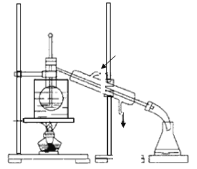
①______,
②______,
③______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 次氯酸钙溶液中通入过量的二氧化碳 Ca2++2ClO﹣+H2O+CO2═CaCO3↓+2HClO
B. Ba(HCO3)2溶液与少量的NaOH溶液反应:Ba2++HCO![]() +OH-==BaCO3↓+H2O
+OH-==BaCO3↓+H2O
C. 用氨水吸收少量二氧化硫 OH﹣+SO2═HSO3﹣
D. 硫酸与氢氧化钡溶液反应:Ba2++SO42-==BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用软锰矿(只含MnO2和MnO)、H2SO4(过量)和FeS2制备MnSO4·H2O的流程如下(已知流程中的FeS2、FeSO4、MnO2、MnO均完全反应):

(1)已知①中只有三个反应,其中两个反应是
MnO+H2SO4MnSO4+H2O
FeS2+H2SO4FeSO4+H2S↑+S↓
完成第三个反应:
___MnO2+___FeSO4+___ ____________MnSO4+___ _________+___ _________
(2)沉淀A、B的化学式分别是____________________、__________________。
(3)滤液X中的溶质有__________;实验室中浓缩滤液Y时使用的玻璃仪器有___________________。
(4)若得到的沉淀A的质量和MnSO4·H2O的质量分别为96.0 g、321.1 g,②中加入的MnO为0.1 mol,则理论上软锰矿中MnO2和MnO的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍及其化合物有许多用途。回答下列问题:
(1)基态铁原子核外共有____________种不同空间运动状态的电子,铁、钴、镍基态原子核外未成对电子数最少的价层电子的电子排布图(轨道表达式)为_________________。
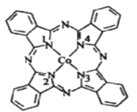
(2)酞菁钴分子的结构简式如图所示,分子中与钴原子通过配位键结合的氮原子的编号是______(填“1”“2”“3”或“4”),分子中三种非金属原子的电负性由大到小的顺序为____________(用相应的元素符号表示),分子中碳原子的杂化轨道类型为____________。
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,该晶体固态下不导电,熔融状态、水溶液均能导电,该晶体属于____(填晶体类型)。配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为16,则x=___。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和74pm,则熔点NiO____FeO(填“>”“<”或“=”),原因是______。
(5)Ni、O、Cr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,晶胞边长为apm,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_______g·cm-3.。
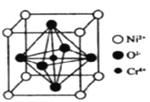
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84 g/cm3 )配制100 mL l mol/L的稀硫酸。现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列正确的是.( )
A.④③⑦⑤⑥;B.②⑤⑦⑥;C.①③⑤⑥⑦;D.②⑥③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧的脱硝反应为:2NO2(g) + O3(g)![]() N2O5(g) + O2(g),一定条件下,向2.0L恒容密闭容器中充入2.0molNO2和1.0 molO3,一段时间后达到平衡。下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化。下列叙述正确的是( )
N2O5(g) + O2(g),一定条件下,向2.0L恒容密闭容器中充入2.0molNO2和1.0 molO3,一段时间后达到平衡。下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化。下列叙述正确的是( )
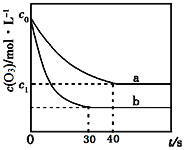
A. 反应2NO2(g) + O3(g)![]() N2O5(g) + O2(g) △S<0
N2O5(g) + O2(g) △S<0
B. 曲线b对应的条件改变可能是加入了催化剂,平衡常数Ka=Kb
C. 曲线b对应的条件改变可能是密闭容器的体积变为4.0L
D. 若c1=0.3mol·L-1,从反应开始到平衡时该反应的速率v(NO2)=0.005 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为98%的浓硫酸(ρ=1.84g·cm-3)配制240mL1.84mol·L-1的稀硫酸。下列叙述正确的是
A. 要用到的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管和容量瓶
B. 量取浓硫酸的体积为24 mL
C. 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,不断搅拌并冷却至室温
D. 先在容量瓶中加入适量水,将量好的浓硫酸注入容量瓶,加水定容
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com