
在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下:
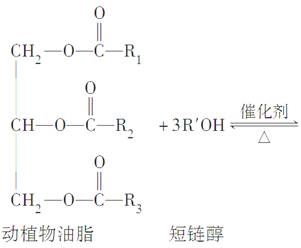
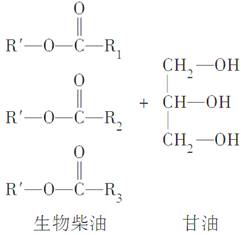
下列叙述错误的是( )
A.生物柴油由可再生资源制得
B.生物柴油是不同酯组成的混合物
C.动植物油脂是高分子化合物
D.“地沟油”可用于制备生物柴油
科目:高中化学 来源: 题型:
在FeCl3、CuCl2和HCl的混合溶液中加入铁粉,待反应结束后,将剩余的固体滤出,发现固体能被磁铁吸引,则反应后溶液中大量存在的阳离子是( )
A.Fe2+ B.H+ C.Cu2+和Fe2+ D.Fe3+和Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应A+3B 2C+2D在不同条件下的反应速率如下,其中反应速率最快的是
2C+2D在不同条件下的反应速率如下,其中反应速率最快的是
A.V(A)=0.15 mol/(L·s) B.V(D)=0.45 mol/(L·s)
C.V(C)=0.4 mol/(L·s) D.V(B)=0.6 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在25℃时,在0.01mol/LNaOH溶液中,C(OH-)= mol/L,由水电离出的H+浓度= mol/L,由水电离出的OH-浓度= mol/L;
(2)在25℃时,在0.01mol/LHCl溶液中, C(H+)= mol/L,由水电离出的OH-浓度= mol/L,PH= 。
(3)在25℃时,100mL0.5mol/L的盐酸和等体积的0.3mol/L氢氧化钠溶液混合后的PH= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.纤维素的水解产物能与新制的Cu(OH)2悬浊液生成红色沉淀
B.正戊烷和环戊烷互为同分异构体
C.在酸性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H OH
OH
D.在稀硫酸存在下,乙酸乙酯的水解反应属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
普伐他汀是一种调节血脂的药物,其结构简式如图所示。下列关于普伐他汀的性质描述不正确的是( )

A.该物质的分子式为C23H38O7
B.能使酸性KMnO4溶液褪色
C.能发生加成、取代、酯化、水解反应
D.1 mol该物质与溴水反应可消耗Br2 2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。

完成下列填空:
(1)用浓盐酸配制1∶1(体积比)的稀盐酸(约6 mol·L-1),应选用的仪器是________(填字母,下同)。
a.烧杯 b.玻璃棒
c.量筒 d.容量瓶
(2)上述装置中,A是______溶液,NaHCO3溶液可以吸收________________。
(3)上述装置中,B物质是________。用这个实验得到的气体测定CO2的分子量,如果B物质失效,测定结果________(填“偏高”、“偏低”或“不受影响”)。
(4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重。为了将石蜡和碳酸钙溶出,应选用的试剂是________。
a.氯化钠溶液 b.稀醋酸
c.稀硫酸 d.正己烷
(5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出________,后溶出________。
(6)上述测定实验中,连续________,说明样品已经恒重。
查看答案和解析>>
科目:高中化学 来源: 题型:
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)===6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1
CaO(s)+SiO2(s)===CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)===6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3=______________kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P4+60CuSO4+96H2O===20Cu3P+24H3PO4+60H2SO4
60 mol CuSO4能氧化白磷的物质的量是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com