
| A. | 缩小容器的体积使压强增大 | B. | 体积不变,充入N2 | ||
| C. | 恒容,充入He | D. | 降低反应温度 |
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
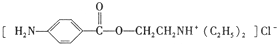 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下: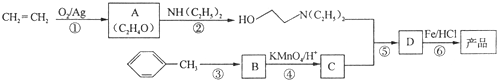
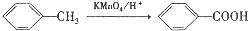
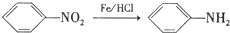
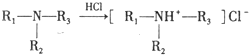
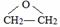 .
.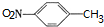 ,C中含氧官能团的名称为硝基、羧基.
,C中含氧官能团的名称为硝基、羧基.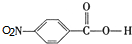 +HOCH2CH2N(C2H5)2 $\stackrel{一定条件下}{→}$
+HOCH2CH2N(C2H5)2 $\stackrel{一定条件下}{→}$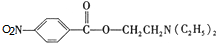 +H2O.
+H2O.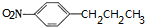 (任写一种).
(任写一种).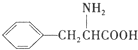 )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式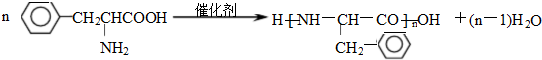 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2+O2?2SO3 △H=-196.6kJ/mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═2H2O(l)△H=-285.8kJ/mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6kJ•mol-1 | |
| D. | C(s)+O2(g)═CO2(g)△H=+395.9kJ/mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 轮船底部焊上锌块可减级船体腐蚀,这种方法称为粞牲阳极的阴极保护法 | |
| B. | 精炼铜时,与电源负极相连的是纯铜,电极反应式为:Cu2++2e-═Cu | |
| C. | 镀层破损后,镀锌铁板比镀锡铁板更耐腐蚀 | |
| D. | 恒温下,用惰性电极电解饱和Na2CO3溶液,溶液浓度变大,有晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制Cu(OH)2悬浊液 | B. | 溴的CCl4溶液 | C. | 银氨溶液 | D. | KMnO4酸性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
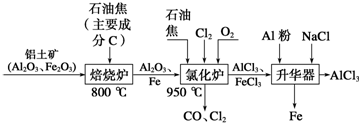
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com