
| A. | 轮船底部焊上锌块可减级船体腐蚀,这种方法称为粞牲阳极的阴极保护法 | |
| B. | 精炼铜时,与电源负极相连的是纯铜,电极反应式为:Cu2++2e-═Cu | |
| C. | 镀层破损后,镀锌铁板比镀锡铁板更耐腐蚀 | |
| D. | 恒温下,用惰性电极电解饱和Na2CO3溶液,溶液浓度变大,有晶体析出 |
分析 A、在原电池中,负极上的金属易被腐蚀,正极上的金属被保护;
B、根据电解精炼铜的原理以及电解池的工作原理来回答;
C、铁、锡和合适的电解质溶液构成的原电池中,铁作负极,易被腐蚀,锌、铁和合适的电解质溶液构成的原电池中,锌作负极,铁作正极被保护;
D、盛有饱和碳酸钠溶液的烧杯中插入惰性电极,保持温度不变,通电时氢离子放电生成氢气,氢氧根离子放电生成氧气,即电解水,结合饱和溶液溶剂减少来解答.
解答 解:A、在轮船外壳焊上金属锌,可以保护金属锌,这是牺牲阳极的阴极保护法,故A正确;
B、精炼铜时,粗铜做阳极,金属锌、铁先于铜失电子,纯铜做阴极,电极反应式为:Cu2++2e-═Cu,故B正确;
C、镀层破损后,镀锡铁板中铁加快腐蚀,镀锌铁板中铁被保护,所以镀锌铁板比镀锡铁板更耐腐蚀,故C正确;
D、盛有饱和碳酸钠溶液的烧杯中插入惰性电极,保持温度不变,通电时氢离子放电生成氢气,氢氧根离子放电生成氧气,即电解水,因温度不变,溶剂减少后还是饱和溶液,则溶液浓度不变,有晶体析出,故D错误;
故选D.
点评 本题考查了原电池原理、电解池原理及金属的腐蚀与防护,易错选项是D,注意用惰性电极电解饱和碳酸钠时,实则电解的是水,溶液中的溶质不变而溶剂改变,导致溶液的浓度改变.


科目:高中化学 来源: 题型:解答题
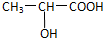
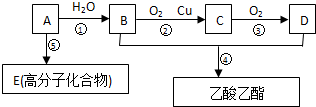
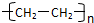

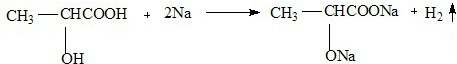 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入溴水,溴水褪色 | |
| B. | 将SO2气体通入滴入有酚酞的NaOH溶液中,红色褪色 | |
| C. | 将SO2通入品红溶液中,品红溶液褪色 | |
| D. | 将SO2通入酸性高锰酸钾溶液中,溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 缩小容器的体积使压强增大 | B. | 体积不变,充入N2 | ||
| C. | 恒容,充入He | D. | 降低反应温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com