
| A. | 将SO2通入溴水,溴水褪色 | |
| B. | 将SO2气体通入滴入有酚酞的NaOH溶液中,红色褪色 | |
| C. | 将SO2通入品红溶液中,品红溶液褪色 | |
| D. | 将SO2通入酸性高锰酸钾溶液中,溶液褪色 |
分析 二氧化硫能和有色物质反应生成无色物质而具有漂白性,二氧化硫具有还原性,能被强氧化剂氧化,还是酸性氧化物,能和碱反应生成盐和水,据此分析解答.
解答 解:A.溴具有强氧化性,二氧化硫具有还原性,二氧化硫和溴水发生氧化还原反应生成硫酸和HBr,所以该反应体现二氧化硫还原性,故A错误;
B.二氧化硫属于酸性氧化物,能和氢氧化钠反应生成亚硫酸钠和水,溶液碱性变弱,则红色褪去,体现二氧化硫属于酸性氧化物,故B错误;
C.二氧化硫和有色物质反应生成无色物质而漂白品红溶液,该实验体现二氧化硫漂白性,故C正确;
D.酸性高锰酸钾溶液具有强氧化性,二氧化硫具有还原性,二氧化硫和酸性高锰酸钾溶液发生氧化还原反应,所以该反应体现二氧化硫还原性,故D错误;
故选C.
点评 本题考查二氧化硫性质,二氧化硫具有氧化性、还原性和漂白性,注意还原性和漂白性区别,二氧化硫漂白性具有暂时性特点,且不能漂白酸碱指示剂,为易错点.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol R(g)的能量总和大于1 mol M(s)与1 mol N(g) 的能量总和 | |
| B. | 将2 mol R (g)与1 mol N(g)在该条件下充分反应,放出热量Q2 kJ | |
| C. | 当1 mol M(s) 与N(g)完全转化为T (g)时(假定无热量损失),放出热量Q1+$\frac{{Q}_{2}}{2}$kJ | |
| D. | M(g)+N(g)?R(g)△H=-Q3 kJ•mol-1,则Q3<Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
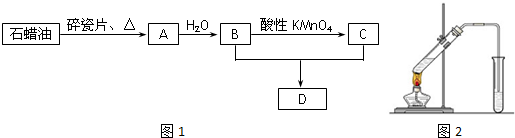
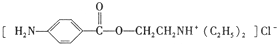 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下: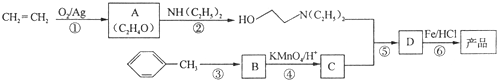
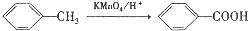
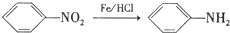
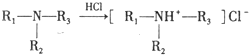
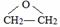 .
.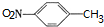 ,C中含氧官能团的名称为硝基、羧基.
,C中含氧官能团的名称为硝基、羧基.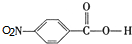 +HOCH2CH2N(C2H5)2 $\stackrel{一定条件下}{→}$
+HOCH2CH2N(C2H5)2 $\stackrel{一定条件下}{→}$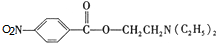 +H2O.
+H2O.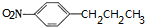 (任写一种).
(任写一种).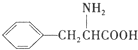 )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式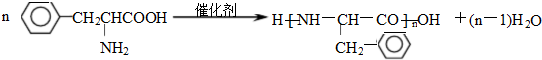 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
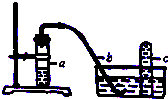 实验室用如图装置,利用Cu与HNO3反应来制取NO并用排水法收集气体.
实验室用如图装置,利用Cu与HNO3反应来制取NO并用排水法收集气体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 轮船底部焊上锌块可减级船体腐蚀,这种方法称为粞牲阳极的阴极保护法 | |
| B. | 精炼铜时,与电源负极相连的是纯铜,电极反应式为:Cu2++2e-═Cu | |
| C. | 镀层破损后,镀锌铁板比镀锡铁板更耐腐蚀 | |
| D. | 恒温下,用惰性电极电解饱和Na2CO3溶液,溶液浓度变大,有晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要点燃后才能发生反应,所以这个反应为吸热反应 | |
| B. | 反应物所具有的总能量高于生成物所具有的总能量 | |
| C. | 断开1molH-H键和1molCl-Cl键所吸收的总能量大于形成2molH-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com