
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )
| R | |||
| T | Q | W |
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.含T的盐溶液一定显酸性
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
下图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是( )

A.反应①是加成反应 B.只有反应②是加聚反应
C.只有反应⑦是取代反应 D.反应④⑤⑥是取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
关于乙烯基乙炔CH C—CH=CH2分子的说法错误的是
C—CH=CH2分子的说法错误的是
A.能使酸性KMnO4溶液褪色
B. 等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
C.乙烯基乙炔分子内含有两种官能团
D. 1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
复方过氧化氢消毒剂具有高效、环保、无刺激无残留,其主要成分H2O2。
(1)H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了甲、乙两种实验装置。

若利用甲实验,可通过观察________现象,从而定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是________;若利用乙实验可进行定量分析,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________。
 (2)在含有表面活性剂的酸性水溶液中,以碳为电极,通直流电进行电解可制取氢气和过氧化氢,过氧化氢在 (填“阴极”、“阳极”)产生。
(2)在含有表面活性剂的酸性水溶液中,以碳为电极,通直流电进行电解可制取氢气和过氧化氢,过氧化氢在 (填“阴极”、“阳极”)产生。
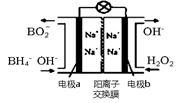
以H2O2和硼氢化合物NaBH4(B的化合价为+3价)作原料的燃料电池,可用作通信卫星电源。其工作原理如图所示,写出a极上的电极反应式: ,正极材料采用MnO2,MnO2除了作电极材料之外还可能具有的作用为
(3)锗(Ge)与碳是同主族元素,最新研究表明有机锗具有明显的抗肿瘤活性,锗不与NaOH 溶液反应,但在有H2O2存在时可与NaOH 溶液反应生成锗酸盐,其化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
A.A、B简单离子半径大小关系为B3+>A2+
B.D、E形成的简单离子的还原性:E->D-
C.气态氢化物的稳定性:HD<H2C
D.最高价氧化物对应的水化物的酸性:H2CO4>HEO4
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:

①第ⅡA族元素的价电子数________。
②第三周期元素的最高正价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
①N的最高价氧化物对应的水化物的化学式为_______________。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,A溶液中水的电离程度比B溶液中水的电离程度小。则化合物A中的化学键类型为________,B的化学式为________。
③工业上制取单质M的化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一。反应:2NO(g)+2CO(g)2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
A.提高尾气净化效率的最佳途径是研制高效催化剂
B.提高尾气净化效率的常用方法是升高温度
C.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
D.570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳
查看答案和解析>>
科目:高中化学 来源: 题型:
将11.9 g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L NO(标准状况下),向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为( )
A.22.1 g B.27.2 g C.30 g D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素A、B、C、D的原子序数依次增大,它们的核电荷数之和为32,原子最外层电子数之和为10;A与C同主族,B与D同主族,A、C原子最外层电子数之和等于B原子次外层电子数,则下列叙述正确的是( )
A.D元素处于元素周期表第3周期ⅥA族
B.四种元素原子半径大小顺序是A<B<C<D
C.B、D的最高价氧化物具有相似的物理性质和化学性质
D.一定条件下,B单质能置换出D单质,C单质能置换出A单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com