
【题目】C和CuO在一定温度下反应,产物有Cu、![]() 、CO、
、CO、![]() 。将
。将![]() 跟
跟![]() 混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,反应一段时间后共收集到
混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,反应一段时间后共收集到![]() 标准状况
标准状况![]() 气体,生成沉淀的质量为
气体,生成沉淀的质量为![]() 。下列说法中不正确的是
。下列说法中不正确的是![]()
![]()
A.反应后的固体混合物中单质Cu的质量为![]()
B.反应后的固体混合物中含有碳
C.反应后的固体混合物总质量为![]()
D.反应后的固体混合物中氧化物的物质的量为![]()
【答案】A
【解析】
反应得到混合气体与通过足量的澄清石灰水,反应一段时间后共收集到1.12L的气体(标准状况)为CO的体积,生成沉淀的质量为5.00g为碳酸钙,据此计算CO、二氧化碳的物质的量,反应后的固体混合物含有Cu、Cu2O,可能含有碳;
A、假设CuO完全被还原为Cu,根据Cu守恒计算生成Cu的质量,由产物中CO2、CO中的O原子守恒计算氧化铜失去氧的质量,进而计算CuO反应后的总质量,与Cu的质量比较判断;
B、根据碳原子守恒计算参加反应的C的质量,进而确定碳是否完全反应来解答;
C、反应后固体混合物总质量=原固体混合物总质量-生成CO2与CO的总质量;
D、Cu2O、CuO均含有1个氧原子,根据剩余的氧原子质量计算,剩余氧原子质量=CuO反应后的总质量-Cu元素的质量。
由题意可知,生成的n(CO2)=n(CaCO3)=![]() =0.05mol,n(CO)=
=0.05mol,n(CO)=![]() =0.05mol,
=0.05mol,
A. 假设CuO完全被还原为Cu,根据Cu守恒生成Cu的质量=![]() ×64g/mol=12.8g,由产物中CO2、CO中的O原子守恒可知失去氧的质量=(0.05mol×2+0.05mol)×16g/mol=2.4g,故CuO反应后的总质量=16g2.4g=13.6g,故反应后固体中Cu的质量小于12.8g,故A符合题意;
×64g/mol=12.8g,由产物中CO2、CO中的O原子守恒可知失去氧的质量=(0.05mol×2+0.05mol)×16g/mol=2.4g,故CuO反应后的总质量=16g2.4g=13.6g,故反应后固体中Cu的质量小于12.8g,故A符合题意;
B. 生成的n(CO2)=n(CaCO3)=0.05mol,n(CO)=0.05mol,根据C守恒可知,参加反应的C的质量=(0.05mol+0.05mol)×12g/mol=1.2g,故没有参与反应的碳的质量为:2g1.2g=0.8g,故B不符合题意;
C. 反应后固体总质量为:16g+2g0.05mol×(44g/mol+28g/mol)=14.4g,故C不符合题意;
D. 反应后m(O)=13.6g12.8g=0.8g,Cu2O、CuO均含有1个氧原子,根据氧原子守恒可知反应后的固体混合物中氧化物的物质的量=![]() =0.05mol,故D不符合题意;
=0.05mol,故D不符合题意;
故答案为:A。


科目:高中化学 来源: 题型:
【题目】将![]() 在一定条件下与
在一定条件下与![]() 反应转化为甲醇
反应转化为甲醇![]() 是变废为宝的好方法,一定条件下,每转化
是变废为宝的好方法,一定条件下,每转化![]() 放出的热量为
放出的热量为![]() ,
,![]() 转化为甲醇过程中浓度随时间的变化曲线如图所示
转化为甲醇过程中浓度随时间的变化曲线如图所示![]() 已知反应物和生成物在此条件下均为气体
已知反应物和生成物在此条件下均为气体![]() ,下列叙述中正确的是
,下列叙述中正确的是

A.在进行到3分钟时,![]() 和
和![]() 所表达的反应速率值相等,均为
所表达的反应速率值相等,均为![]()
B.此反应的热化学方程式为:![]()
C.此条件下反应的平衡常数为![]()
D.降低温度,此反应的平衡常数可能为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法正确的组合是( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、H2O、H2S晶体的熔点依次降低
④离子化合物中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻

⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠溶于水时离子键被破坏
A. ①②③⑥B. ①②④C. ③⑤⑦D. ③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO和H2组成的混合气体2.4g在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为
A. 1.2g B. 2.4 g C. 3.6![]() g D. 无法计算
g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某![]() 溶液中,通入
溶液中,通入![]() 标准状况下
标准状况下![]() 的
的![]() ,测得溶液中
,测得溶液中![]() 。反应过程中溶液的体积变化忽略不计,则下列说法中正确的是
。反应过程中溶液的体积变化忽略不计,则下列说法中正确的是
A.原溶液的浓度为![]()
B.反应后溶液中![]()
C.反应后溶液中![]()
D.原溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.研究表明: CO2和 CO可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)枯竭危机。
(1)目前工业上有一种方法是用 CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例,该过程分两步进行:
反应 I: CO2(g)+H2(g)![]() CO(g)+ H2O(g) △H =+41.3kJ·mol -1
CO(g)+ H2O(g) △H =+41.3kJ·mol -1
反 应 II: 2CO(g)+ 4H2(g) ![]() C2H4(g) +2H2O(g) △H =-210.5kJ·mol -1
C2H4(g) +2H2O(g) △H =-210.5kJ·mol -1
①CO2加氢合成乙烯的热化学方程式为_____。
②一定条件下的密闭容器中,上述反应 I 达到平衡后,要加快反应速率并提高 CO2 的转化率,可以采取的措施是_____(填字母)。
A.减小压强
B 分离出水蒸气.
C.加入适当催化剂
D.增大 H2浓度
E.升高温度
(2)将不同物质的量的H2O(g)和 CO(g)分别通入体积为 2 L 的恒容密闭容器中,进行反应:H2O(g)+CO(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/ mol | 平衡量/ mol | 达到平衡所 需时间/min | ||
H2O | CO | CO | H2 | |||
Ⅰ | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
Ⅱ | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
Ⅲ | 900 | a | b | c | d | t |
若 a=2,b=1,则 c=_____,达到平衡时实验组Ⅱ中 H2O(g)和实验组Ⅲ中 CO的转化率的关系为 αⅡ(H2O)_____(填“<”“>”或“=”)αⅢ(CO)。
(3)可以用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g),已知一定条件下,该反应中 CO 的平衡转化率随温度、投料比 n(H2)/ n(CO)的变化曲线如图所示。
CH3OCH3(g)+H2O(g),已知一定条件下,该反应中 CO 的平衡转化率随温度、投料比 n(H2)/ n(CO)的变化曲线如图所示。
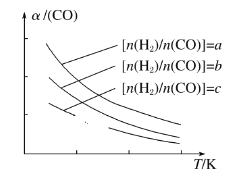
①a、b、c 按从大到小的顺序排序为_____
②根据图像可以判断该反应为放热反应,理由是_________________
(4)工业上还可利用 CO或 CO2来生产燃料甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2 | K2 | 1.0 | 2.50 |
③3H2(g)+CO2 | K3 | ||
据反应①与②可推导出 K1、K2 与 K3之间的关系,则 K3=_____(用 K1、K2 表示); 反应③的ΔH_____(填“>”或“<”)0。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】桥环烃是指由两个碳环共用两个或两个以上碳原子的一类环烃,二环[1,1,0]丁烷( ) 是最简单的一种桥环烃。下列关于该化合物的说法错误的是( )
) 是最简单的一种桥环烃。下列关于该化合物的说法错误的是( )
A.与![]() 互为同分异构体
互为同分异构体
B.二氯代物共有4种
C.所含碳碳键不只是单键
D.每个碳原子均处于与其直接相连的原子构成的四面体内部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氯气通入300 mL 浓度为lmol/L的NaOH 溶液中恰好完全反应,加热少许时间后溶液中形成NaCl、NaClO及NaClO3的共存体系.下列判断不正确的是
A. n(Na+):n(C1-)可能为7:3
B. n(NaCl):n(NaClO):n(NaClO3)可能为11:1:2
C. 参加反应氯气物质的量为0.15mol
D. 反应中转移电子物质的量n的范围:0.15mol<n<0.25mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】举世闻名的侯氏制碱法的工艺流程如下图所示,下列说法正确的是( )
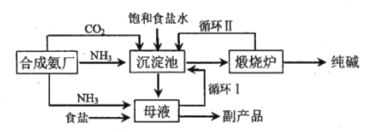
A.往母液中加入食盐的主要目的是使![]() 更多的析出
更多的析出
B.从母液中经过循环Ⅰ进入沉淀池的主要是![]() 、
、![]() 和氨水
和氨水
C.沉淀池中反应的化学方程式:![]()
D.设计循环Ⅱ的目的是使原料氯化钠的利用率大大提升
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com