
【题目】如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )

A.发生的反应可表示为2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
B.开始时,正、逆反应同时开始
C.前2min内A的分解速率为0.1mol·L-1·min-1
D.2min时,A、B、C的浓度之比为2∶3∶1
【答案】B
【解析】
A.据图可知A浓度减小,应为反应物,B、C的浓度增大,应为生成物;相同时间内△c(A)=0.2mol/L,△c(B)=0.2mol/L,△c(C)=0.1mol/L,同一反应同一时段内反应速率之比等于计量数之比,所以A、B、C的计量数之比为0.2:0.2:0.1=2:2:1,所以反应方程式为2A(g)![]() 2B(g)+C(g),故A正确;
2B(g)+C(g),故A正确;
B.据图可知开始时C的浓度为0,所以此时逆反应速率应为0,故B错误;
C.前2min内△c(A)=0.2mol/L,所以A的分解速率为0.1mol·L-1·min-1,故C正确;
D.据图可知2min时,c(A)=0.2mol/L,c(B)=0.3mol/L,c(C)=0.1mol/L,浓度之比为2:3:1,故D正确;
故答案为B。


科目:高中化学 来源: 题型:
【题目】Cu4O(PO4)2是锂-磷酸氧铜电池正极的活性物质,它可通过下列反应制备:2Na3PO4+CuSO4+2NH3·H2O= Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu的电子排布式:_____。
(2)PO43-的空间构型是______。
(3)P、S、N元素第一电离能由大到小顺序为_____。
(4)氨基乙酸铜分子结构如下图,其中碳原子的杂化方式为____,基态碳原子核外电子有__种运动状态。

(5)晶胞原子坐标参数,表示晶胞内部各原子的相对位置,图1为铜与氧形成的某化合物晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0),则D原子的坐标参数为______。
,0),则D原子的坐标参数为______。
(6)图2为铜晶体中铜原子的堆积图,则晶体铜原子的堆积方式为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用氢氧化钙和氯化铵固体制备NH3并探究其探究其性质。回答下列问题:
⑴制备NH3时发生反应的化学方程式为__;选取下图中装置制备并收集NH3,正确的连接顺序为_(填装置序号)。

⑵利用下图装置探究NH3的性质(实验开始前所有旋塞均关闭)

打开旋塞K1、K2,烧瓶中的实验现象为___;充分反应后,关闭旋塞K1,打开旋塞K3,烧瓶中的实验现象为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂解可以得到乙烯、丙烯等小分子烃,它们是常见的有机化工原料。下图是以丙烯为原料合成有机物I的流程。
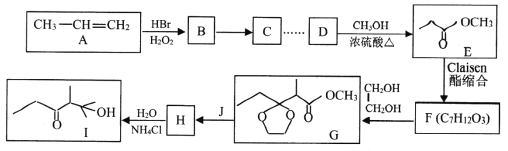
已知:
i.Claisen酯缩合: ![]()
ii. 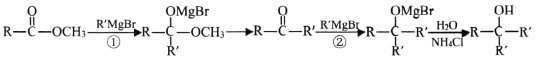 (②比①反应快)
(②比①反应快)
iii.![]() ,(R、R'代表烃基)
,(R、R'代表烃基)
回答下列问题:
(1)C的名称为_____________。Ⅰ中所含官能团的名称为______________________。
(2)B→C的反应类型是_______________。F的结构简式为_______________________。
(3)D→E的化学方程式为___________________________。
(4)由F到H过程中增加一步先生成G再生成H的目的是__________________________。
(5)化合物K与E互为同分异构体,已知1molK能与2mol金属钠反应,则K可能的链状稳定结构有_______种(两个一OH连在同一个碳上不稳定:一OH连在不饱和的双键碳、叁键碳不稳定),其中核磁共振氢谱有三组峰的结构简式为_______________。(任写一种)
(6)完成下列以苯乙烯为原料,制备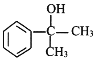 的合成路线(其他试剂任选) _____________。
的合成路线(其他试剂任选) _____________。
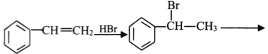
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO和H2生产燃料甲醇(CH3OH)。一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态)。下列说法错误的是

A.反应的化学方程式:CO+2H2CH3OH
B.反应进行至3分钟时,正、逆反应速率相等,反应达到平衡状态
C.反应至10分钟,CO的转化率为75%
D.反应至3分钟,用甲醇来表示反应的平均速率为![]() mol/(L·min1)
mol/(L·min1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3-)(填“>”、“<”或“=”)。
②常温下,物质的量浓度相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其pH由大到小的顺序是________(填编号)。
③将少量CO2通入NaCN溶液,反应的离子方程式是__________。
④室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是______,溶液中c(CH3COO-)/c(CH3COOH) =________。
(2)某温度下, PH=3的盐酸中[OH-]=10-9 mol/L. 该温度下, PH=2的H2SO4与PH=11的NaOH混合后PH变为9,则硫酸与氢氧化钠的体积比为______.
(3)室温下,用0.100 mol/L盐酸溶液滴定20.00mL 0.l00mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。

①d点所示的溶液中离子浓度由大到小的顺序依次为_____。
②b点所示的溶液中c(NH4+)-c(NH3·H2O)=______(写出准确数值)。
(4)在SO2溶于水形成的二元弱酸溶液中,含S元素的某微粒占所有含S元素微粒的物质的量分数与溶液pH的关系如下图所示,该微粒的化学式为_______;该二元弱酸的一级电离常数为Ka1,则pKa1=-lgKa1≈____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)为一元弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,H3BO3可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法错误的是
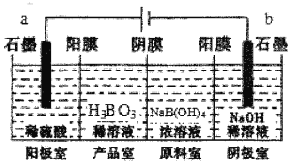
A.阳极的电极反应式为:2H2O-4e-=O2↑+4H+
B.反应一段时间以后,阴极室NaOH溶液浓度增大
C.当电路中通过3mol电子时,可得到1molH3BO3
D.B(OH)4-穿过阴膜进入产品室,Na+穿过阳膜进入阴极室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍是一种重要的电子元件材料、蓄电池材料。工业上利用含镍废料(以镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。根据下列工艺流程示意图回答问题。
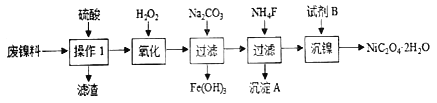
下列说法不正确的是
A. 操作1的名称为过滤,为了加快过滤速度要使用玻璃棒搅拌
B. 加入H2O2的目的是将 Fe2+氧化为 Fe3+
C. 加入NH4F的目的是除去钙离子、镁离子
D. 试剂 B的名称为草酸或可溶性的草酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热还原法制备MgO材料的原理为MgSO4(s)+CO(g)![]() MgO(s)+SO2(g)+CO2(g) △H>0,T℃时,在一恒容密闭容器中加入一定量的MgSO4(s)和CO(g),一段时间后达到平衡状态。下列说法正确的是( )
MgO(s)+SO2(g)+CO2(g) △H>0,T℃时,在一恒容密闭容器中加入一定量的MgSO4(s)和CO(g),一段时间后达到平衡状态。下列说法正确的是( )
A. 活化能:E正>E逆
B. 其他条件不变,加入催化剂,△H减小
C. 其他条件不变,降低温度,化学平衡常数增大
D. 其他条件不变,向容器中通入Ar(g),平衡逆向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com