
【题目】硼酸(H3BO3)为一元弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,H3BO3可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法错误的是
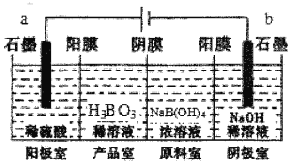
A.阳极的电极反应式为:2H2O-4e-=O2↑+4H+
B.反应一段时间以后,阴极室NaOH溶液浓度增大
C.当电路中通过3mol电子时,可得到1molH3BO3
D.B(OH)4-穿过阴膜进入产品室,Na+穿过阳膜进入阴极室
【答案】C
【解析】
A. 电解时阳极a上H2O失电子生成O2和H+,电极反应式为2H2O4e=O2↑+4H+,故B正确;
B. 阴极电极反应式为4H2O+4e=2H2↑+4OH,反应一段时间以后,阴极室NaOH溶液浓度增大,故B正确;
C. 阳极电极反应式为2H2O4e=O2↑+4H+,电路中通过3mol电子时有3molH+生成,硼酸(H3BO3)为一元弱酸,生成1mol硼酸需要1molH+,所以电路中通过3mol电子时,可得到3molH3BO3,故C错误;
D. 阳极电极反应式为2H2O4e=O2↑+4H+、阴极电极反应式为4H2O+4e=2H2↑+4OH,阳极室中的氢离子穿过阳膜进入产品室,原料室中Na+穿过阳膜进入阴极室,B(OH)4-穿过阴膜进入产品室,故D正确;
答案选C。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】某有机物R的结构如右所示。下列说法不正确的是

A. R的分子式为C9H8O5
B. R分子中的所有原子可能共平面
C. R能发生酯化、水解、加成反应
D. 与R含有相同取代基的苯环上的位置异构体还有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
⑴①元素的名称:_______,⑧元素的符号:_______;
⑵在这些元素中,最活泼的金属元素的离子结构示意图是____,最活泼的非金属元素是____(填元素符号,下同),____是最不活泼的元素;
⑶这些元素的最高价氧化物对应水化物中,______(填化学式,下同)酸性最强,________碱性最强;能形成两性氢氧化物的元素是____(填元素符号);
⑷在⑤到的元素中,_______(填元素符号)原子半径最小;
⑸⑤和⑦两种元素最高价氧化物对应的水化物相互反应的离子方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )

A.发生的反应可表示为2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
B.开始时,正、逆反应同时开始
C.前2min内A的分解速率为0.1mol·L-1·min-1
D.2min时,A、B、C的浓度之比为2∶3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。回答下列问题:
(1)已知2NO2(g)=N2O4(g) △H=-55.3kJ/mol;N2O5(g)=2NO2 (g)+![]() O2(g) △H=+53.1 kJ/mol;写出N2O5分解生成N2O4与O2的热化学方程式________________
O2(g) △H=+53.1 kJ/mol;写出N2O5分解生成N2O4与O2的热化学方程式________________
(2)一定温度下2N2O5(g)=4NO2(g)+O2(g),在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是______(填字母序号)。
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5) d.气体密度不变
(3)以乙烯(C2H4)作为还原剂脱硝(NO),脱硝机理如图1。若反应中n(NO)︰n(O2)=2︰1,则总反应的化学方程式为_____;脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2,为达到最佳脱硝效果,应采用的条件是负载率____温度____。

(4)T温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:

①从0~2s内该反应的平均速率v(NO)=________。
②T1温度时化学平衡常数K=_________ (结果保留3位有效数字)。
③若将容器的温度改变为T2时其k正=k逆,则T2_______T1(填“>”、“<”或“=")
④已知2NO(g)+O2(g)![]() 2NO2的反应历程为:
2NO2的反应历程为:
第一步NO+NO![]() N2O2 快速平衡 第二步N2O2+O2→2NO2 慢反应
N2O2 快速平衡 第二步N2O2+O2→2NO2 慢反应
下列叙述正确的是________(填标号)。
A.v(第一步的正反应)<v(第二步的反应) B.总反应快慢由第二步决定
C.第二步的活化能比第一步的高 D.第二步中N2O2与O2的碰撞100%有效
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,0.3molX(g)与Y(g)在容积固定的密闭容器中发生反应:X(g)+3Y(g) ![]() 2Z(g), ΔH=-aKJ/mol,下列说法正确的是
2Z(g), ΔH=-aKJ/mol,下列说法正确的是
A. 反应一段时间后,X与Y的物质的量之比仍为1:1
B. 达到平衡时,且反应放出0.1aKJ的热量
C. 达到平衡后,若向平衡体系中充入西游气体,Z的正反应速率将不发生变化
D. X的体积分数保持不变,说明反应已达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是

A.在0-50min之间, pH =2 和 PH= 7 时 R 的降解百分率相等
B.溶液酸性越强, R 的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在 20-25min之间, pH = 10 时 R 的平均降解速率为 0.04mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是几种烷烃的球棍模型,试回答下列问题:

(1) A、B、C 三者的关系是_______________
(2) A 的分子式为_______________,C 的名称为______________
(3)写出C 的同分异构体的结构简式______________
(4) B 是 2008 年北京奥运会火炬燃料的主要成分,若 22g B 气体完全燃烧,生成 CO2 气体和液态水,放出 1108 kJ 热量,则其燃烧的热化学方程式为_____________________________________________________________________________________.
(5)D 为六个碳的烷烃,且其一氯代物只有两种,写出 D 的结构简式_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b﹤d。符合上述实验结果的盐溶液是
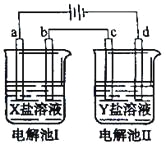
选项 | X | Y |
A. | MgSO4 | CuSO4 |
B. | AgNO3 | Pb(NO3)2 |
C. | FeSO4 | Al2(SO4)3 |
D. | CuSO4 | AgNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com