
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。回答下列问题:
(1)已知2NO2(g)=N2O4(g) △H=-55.3kJ/mol;N2O5(g)=2NO2 (g)+![]() O2(g) △H=+53.1 kJ/mol;写出N2O5分解生成N2O4与O2的热化学方程式________________
O2(g) △H=+53.1 kJ/mol;写出N2O5分解生成N2O4与O2的热化学方程式________________
(2)一定温度下2N2O5(g)=4NO2(g)+O2(g),在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是______(填字母序号)。
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5) d.气体密度不变
(3)以乙烯(C2H4)作为还原剂脱硝(NO),脱硝机理如图1。若反应中n(NO)︰n(O2)=2︰1,则总反应的化学方程式为_____;脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2,为达到最佳脱硝效果,应采用的条件是负载率____温度____。

(4)T温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:

①从0~2s内该反应的平均速率v(NO)=________。
②T1温度时化学平衡常数K=_________ (结果保留3位有效数字)。
③若将容器的温度改变为T2时其k正=k逆,则T2_______T1(填“>”、“<”或“=")
④已知2NO(g)+O2(g)![]() 2NO2的反应历程为:
2NO2的反应历程为:
第一步NO+NO![]() N2O2 快速平衡 第二步N2O2+O2→2NO2 慢反应
N2O2 快速平衡 第二步N2O2+O2→2NO2 慢反应
下列叙述正确的是________(填标号)。
A.v(第一步的正反应)<v(第二步的反应) B.总反应快慢由第二步决定
C.第二步的活化能比第一步的高 D.第二步中N2O2与O2的碰撞100%有效
【答案】2N2O5(g)=2N2O4(g)+O2(g) △H=-4.4kJ/mol b 6NO+3O2+2C2H4![]() 3N2+4CO2+4H2O 3.0% 350℃左右 0.03 mol/(L·s) 363 > BC
3N2+4CO2+4H2O 3.0% 350℃左右 0.03 mol/(L·s) 363 > BC
【解析】
(1)已知①2NO2(g)=N2O4(g) △H=-55.3kJ/mol,②N2O5(g)=2NO2(g)+1/2O2(g) △H=+53.1kJ/mol,由盖斯定律,将①+②得N2O5(g)=N2O4(g)+1/2O2(g) △H=-55.3kJ/mol+(+53.1kJ/mol)=-2.2kJ/mol即2N2O5(g)=2N2O4(g)+O2(g) △H=-4.4kJ/mol,故答案为:2N2O5(g)=2N2O4(g)+O2(g) △H=-4.4kJ/mol。
(2)a. NO2和O2的浓度比保持不变,不能说明达到化学平衡状态,故a错误;
b.容器中压强不再变化,反应乙达到化学平衡状态,故b正确;
c.v正(NO2)=2v逆(N2O5)才表明达到化学平衡状态,故c错误;
d.气体的质量和体积不变,气体的密度始终保持不变,故d错误。
故答案为:b。
(3)根据图1可知,以乙烯作为还原剂脱硝(NO),使其转化为无毒的氮气,乙烯被氧化为二氧化碳,若反应中n(NO)︰n(O2)=2︰1,则总反应的化学方程式为:6NO+3O2+2C2H4![]() 3N2+4CO2+4H2O,由图2可知,b曲线的最高点处,脱硝率高,负载率低,温度温度适宜,适宜适合条件为350℃、负载率3%,故答案为:6NO+3O2+2C2H4
3N2+4CO2+4H2O,由图2可知,b曲线的最高点处,脱硝率高,负载率低,温度温度适宜,适宜适合条件为350℃、负载率3%,故答案为:6NO+3O2+2C2H4![]() 3N2+4CO2+4H2O;350℃、负载率3%。
3N2+4CO2+4H2O;350℃、负载率3%。
(4)①0~2s内该反应的平均速率v(NO)=![]() =0.03 mol/(L·s),故答案为:0.03 mol/(L·s)。
=0.03 mol/(L·s),故答案为:0.03 mol/(L·s)。
② 2NO(g)+O2(g)![]() 2NO2
2NO2
n(始)/mol 0.20 0.10 0
△n(始)/mol 0.14 0.07 0.14
n(平)/mol 0.06 0.03 0.14
所以根据化学平衡常数的定义可得K= =363L/mol,故答案为:363。
=363L/mol,故答案为:363。
③若将容器的温度改变为T2时其k正=k逆,则由于![]() =1<363,说明平衡逆向移动,根据温度对化学平衡移动的影响,升高温度,化学平衡向吸热的逆反应方向移动,所以T2>T1,故答案为:>。
=1<363,说明平衡逆向移动,根据温度对化学平衡移动的影响,升高温度,化学平衡向吸热的逆反应方向移动,所以T2>T1,故答案为:>。
④A.由于第一步反应为快反应,第二步反应为慢反应,所以反应速率:v(第一步的正反应)>v(第二步的反应),故A错误;
B.当化学反应分多步进行时,总反应快慢由反应慢的化学反应决定,对该反应来说由第二步决定,故B正确;
C.反应快说明反应的活化能低,需要较少的能量反应就可以发生,反应慢说明反应的活化能高,发生反应需要较高的能量,所以第二步的活化能比第一步的高,故C正确;
D.即便是反应慢的化学反应,反应物分子之间的碰撞也不都是有效碰撞,所以第二步中N2O2与O2的碰撞不可能100%有效,故D错误。
故答案为:BC。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 氢氧化钡溶液中加入硫酸铵:Ba2++OH-+NH4++SO42-=BaSO4↓+NH3·H2O
B. 用惰性电极电解CuCl2溶液:Cu2++2Cl-+2H2O![]() Cu(OH)2↓+H2↑+Cl2↑
Cu(OH)2↓+H2↑+Cl2↑
C. 向漂白粉溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D. 向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A可以作水果的催熟剂,D是食醋的主要成分。相关的转化关系如下:请回答下列问题:
⑴A的结构简式为__________,反应①的反应类型是_______。
⑵B的同分异构体的结构简式为______;C的官能团名称是_______。
⑶反应③的化学方程式为_______________,该反应类型是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO和H2生产燃料甲醇(CH3OH)。一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态)。下列说法错误的是

A.反应的化学方程式:CO+2H2CH3OH
B.反应进行至3分钟时,正、逆反应速率相等,反应达到平衡状态
C.反应至10分钟,CO的转化率为75%
D.反应至3分钟,用甲醇来表示反应的平均速率为![]() mol/(L·min1)
mol/(L·min1)
查看答案和解析>>
科目:高中化学 来源: 题型:
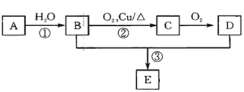
【题目】(1)为了验证 Fe2+与 Cu2+氧化性强弱,下列装置能达到实验目的的是_______(填装置序号), 其正极的电极反应式为_______;若构建该原电池时两个电极的质量相等,当导线中通过 0.4 mol 电子时,两个电极的质量差为_______g。
(2)将 CH4 设计成燃料电池,其利用率更高,装置如图所示(A、B 为多孔碳棒)。

实验测得 OH- 定向移向 A 电极,则_______(填 A 或 B)处电极入口通 CH4,其电极反应式为_______。
(3)金属冶炼和处理常涉及氧化还原反应。由下列物质冶炼相应金属时采用电解法的是_______(填选 项字母)。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)为一元弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,H3BO3可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法错误的是
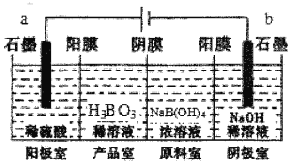
A.阳极的电极反应式为:2H2O-4e-=O2↑+4H+
B.反应一段时间以后,阴极室NaOH溶液浓度增大
C.当电路中通过3mol电子时,可得到1molH3BO3
D.B(OH)4-穿过阴膜进入产品室,Na+穿过阳膜进入阴极室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有Ag+的酸性溶液中,以铁铵矾NH4Fe(SO4)2作指示剂,用KSCN的标准溶液滴定Ag+.已知:AgSCN(白色s)![]() Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-
Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-![]() [Fe(SCN)] 2+(红色),K=138。下列说法不正确的是( )
[Fe(SCN)] 2+(红色),K=138。下列说法不正确的是( )
A. 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀
B. 当Ag+定量沉淀后,少许过量的SCN-与Fe3+生成红色配合物,即为终点
C. 上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+
D. 滴定时,必须控制溶液一定的酸性,防止Fe3+水解,影响终点的观察
查看答案和解析>>
科目:高中化学 来源: 题型:
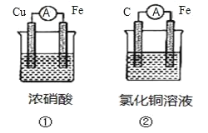
【题目】下列电化学装置能达到目的的是

A.图甲:制取少量Fe(OH)2
B.图乙:证明铁发生了析氢腐蚀
C.图丙:在铁表面镀锌
D.图丁:实现原电池反应Cu+2Fe3+=Cu2++2Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两种化合物的结构或性质描述正确的是( )
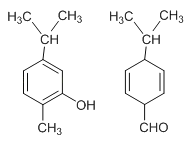
A. 两种化合物均是芳香烃
B. 两种化合物互为同分异构体,均能与溴水反应
C. 两种化合物分子中共平面的碳原子数相同
D. 两种化合物可用红外光谱区分,但不能用核磁共振氢谱区分
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com