
| A. | 无水CuSO4 | B. | CuO | C. | Cu(OH)2 | D. | CuCO3 |
分析 用铂电极电解CuSO4溶液,开始时阳极上OH-放电生成氧气、阴极上铜离子放电生成Cu;当铜离子完全放电后,阴极上H+放电生成氢气,所以当阴极端发现有气体产生时,继续再通电一会,说明此时阳极上生成氧气、阴极上生成氢气,根据“析出什么加入什么“原则加入物质使溶液恢复原状.
解答 解:用铂电极电解CuSO4溶液,开始时阳极上OH-放电生成氧气、阴极上铜离子放电生成Cu,所以相当于析出CuO;当铜离子完全放电后,阴极上H+放电生成氢气,所以当阴极端发现有气体产生时,继续再通电一会,说明此时阳极上生成氧气、阴极上生成氢气,相当于析出H2O,电解总过程中相当于析出CuO、H2O,根据“析出什么加入什么“原则加入物质使溶液恢复原状,则加入的物质可能是Cu(OH)2,
故选C.
点评 本题考查电解原理,为高频考点,侧重考查学生分析判断能力,明确离子放电顺序是解本题关键,注意如果Cu(OH)2改写为CuO.H2O,更容易得出正确结论,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 洗涤沉淀的方法是直接向过滤器中加入适量蒸馏水,然后让水自然流下 | |
| B. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| C. | 用100ml量筒量取9.5 mL的液体 | |
| D. | 焰色反应中,观察焰色后应趁热将铂丝插入到稀硫酸中,然后再次灼烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| B. | 1molN2与4molH2反应生成的NH3分子数为2NA | |
| C. | 标准状况下,2.24LCCl4含有的共价键数为0.4NA | |
| D. | 14g乙烯和丙烯混合气体中的氢原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1NaCl溶液含有NA个Na+ | |
| B. | 1mol Cl2与足量的铝反应,转移的电子数为3NA | |
| C. | 1 mol Na 与足量O2 反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| D. | 铁和酸反应,放出标准状况下的22.4L气体,转移的电子数必为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
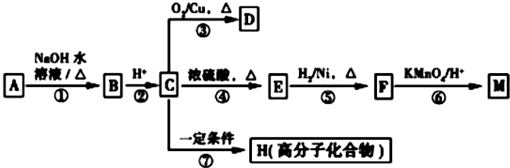
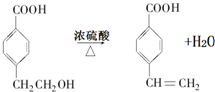
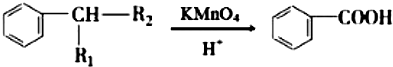 (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子)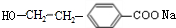 .
. .
.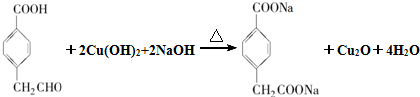 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 按要求填空:
按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
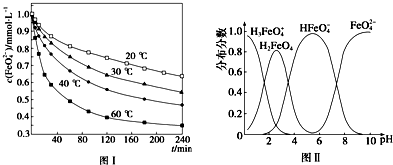
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com