
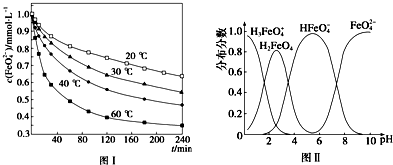
分析 (1)根据元素守恒和化合价的变化分析;高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,形成胶体具有吸附悬浮杂质的作用;
(2)温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小;温度越高FeO42-浓度越小,正向反应是吸热反应;
(3)根据图象的内容来分析图象所描述的意义;
(4)平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比.
解答 解:(1)根据元素守恒可知未知产物应含氧元素,反应中Fe元素化合价降低,则氧元素化合价升高,所以产物为氧气,根据原子守恒可知为3O2;高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,形成胶体具有吸附悬浮杂质的作用;
故答案为:3O2↑;杀菌消毒、吸附悬浮物;
(2)由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小,温度越高FeO42-浓度越小,正向反应是吸热反应;
故答案为:温度升高,反应速率加快,平衡向正反应方向移动;>;
(3)A、不同PH值时,溶液中铁元素的存在形态及种数不相同,比如在PH值等于6时,就只有两种形态,故A错误;
B.根据图片知,改变溶液的pH,当溶液由pH=2变化至pH=10的过程中,HFeO4-的分布分数先增大后减小,故正确;
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O,故C错误;
故答案为:B;
(4)HFeO4-?H++FeO42-的电离平衡常数表达式为K=$\frac{c({H}^{+})c(Fe{{O}_{4}}^{2-})}{c(HFe{{O}_{4}}^{-})}$,故答案为:$\frac{c({H}^{+})c(Fe{{O}_{4}}^{2-})}{c(HFe{{O}_{4}}^{-})}$.
点评 本题考查了缺项方程式的配平、电离平衡、温度对平衡的影响等知识点,题目难度中等,注意对图象的分析是解题的关键.


科目:高中化学 来源: 题型:实验题
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无水CuSO4 | B. | CuO | C. | Cu(OH)2 | D. | CuCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究和开发CO2 和CO的创新利用是环境保护和资源利用的双赢的课题.
研究和开发CO2 和CO的创新利用是环境保护和资源利用的双赢的课题.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 组成物质分别是 | |||||
| 质 量 为(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
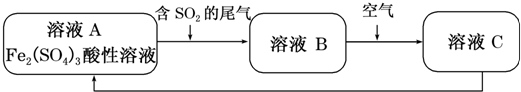
| A. | 向C溶液中滴加KSCN溶液,溶液变为血红色 | |
| B. | 溶液B转化为溶液C发生的变化的离子方程式为4H++2Fe2++O2═2Fe3++2H2O | |
| C. | 溶液酸性A>B>C | |
| D. | 加氧化亚铁可以使溶液C转化为溶液A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=$\frac{PM}{2000ρ}$ | B. | P=$\frac{200ρa}{M}$ | C. | P$\frac{1000ρ×a%}{M}$×2 | D. | V×ρ×a%=$\frac{PMV}{1000}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com