
【题目】以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:


氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)写出制备 NH4Cl的化学方程式:_____________ 。
(2)实验室进行蒸发浓缩用到的主要仪器有___________、烧杯、玻璃棒、酒精灯等。
(3)实验过程中趁热过滤的目的是____________________。
(4)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体____。
A.缓慢冷却溶液 B.溶液浓度较高 C.溶质溶解度较小 D.缓慢蒸发溶剂
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是____________。某研究性学习小组为测定该NH4Cl产品中氮的含量,设计了如图装置,并进行了讨论。

甲同学:根据此实验测得的数据,计算的NH4Cl产品的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:____________________________。
乙同学:实验过程中,往烧瓶中加入的浓氢氧化钠溶液一定要足量并充分加热,原因是___________________________________________。
用改进后的实验装置重新进行实验,称取13.5gNH4Cl产品,测得实验后B装置增重3.4g。则该化肥含氮量为___________ 。
【答案】 (NH4)2SO4+2NaCl![]() Na2SO4+2NH4Cl 蒸发皿 防止氯化铵晶体析出而损耗 AD 重结晶 A、B装置间缺一个干燥装置 使氯化铵充分反应完全转化为NH3 20.7%
Na2SO4+2NH4Cl 蒸发皿 防止氯化铵晶体析出而损耗 AD 重结晶 A、B装置间缺一个干燥装置 使氯化铵充分反应完全转化为NH3 20.7%
【解析】(1)由溶解度曲线可知,氯化铵的溶解度受温度影响较大,尤其是温度大于40℃时,硫酸钠溶解度随温度升高反而降低,故可利用复分解反应生成氯化铵,冷却热的饱和溶液结晶即可,制备NH4Cl的化学方程式为:(NH4)2SO4+2NaCl![]() Na2SO4+2NH4Cl。
Na2SO4+2NH4Cl。
(2)蒸发操作中的仪器有蒸发皿、玻璃棒、酒精灯、铁架台(带铁圈)等。
(3)趁热过滤,除去硫酸钠,得到氯化铵溶液,防止温度降低,氯化铵晶体析出而损失,所以应“趁热”过滤。
(4)静置、缓慢冷却、溶剂自然蒸发,避免了局部过浓导致的过饱和,利于得到较大的晶体,故选AD。
(5)氯化铵的溶解度受温度影响较大,40℃以上时硫酸钠溶解度受温度影响小,故NH4Cl产品中含有硫酸钠杂质,可采用反复多次结晶的方法进一步提纯产品,即重结晶法;甲同学:A、B装置间缺一个干燥装置,氨气在进入B之前没被干燥,所以含氮量偏高;乙同学:烧瓶中发生的是强碱与铵盐溶液的反应:NH4++OH-= NH3↑+H2O,要使铵根离子全部转化为氨气,碱要足量并充分加热;实验后B装置增重3.4g即为氨气的质量,所以氮元素的质量为3.4g×![]() =2.8g,所以含氮量为2.8g÷13.5g×100%≈20.7%。
=2.8g,所以含氮量为2.8g÷13.5g×100%≈20.7%。


科目:高中化学 来源: 题型:
【题目】镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图。反应中镁和铝的 ( )
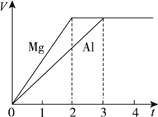
A. 摩尔质量之比为2∶3
B. 物质质量之比为3∶2
C. 物质的量之比为3∶2
D. 物质的量之比为2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中,不正确的是
A. 焰火的五彩缤纷是某些金属元素的性质的展现
B. SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱
C. “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关
D. 根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份100 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:

(1)原NaOH溶液的物质的量浓度为________。
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为________ L。
(3)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是________________,其物质的量之比为________。
(4)曲线B表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是________________,其物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
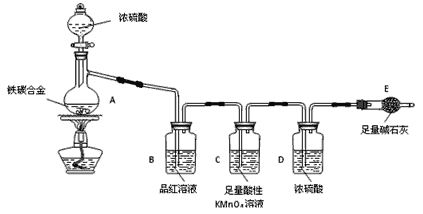
I.测定铁的质量分数:
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后___________________________________________________________________,则证明装置的气密性良好。
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。铁碳合金中铁的质量分数为______________________(写表达式)。
(3)装置C的作用______________________________________________。s5
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是空气中CO2、水蒸气进入E管使b增大。你认为改进的方法是________________________________________。
(5)乙同学认为,即使甲同学认为的偏差得到改进,依据此实验测得合金中铁的质量分数也可能会偏高。你认为其中的原因是________________________________________________________。
Ⅱ.探究浓硫酸的某些性质:
(6)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:_______________________________________。
(7)A中铁与浓硫酸发生反应的化学方程式是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 酸性氧化物和碱性氧化物都是电解质
B. 将NaOH溶液逐滴加入FeCl3溶液可制备Fe(OH)3胶体
C. 电化学腐蚀是造成金属腐蚀的主要原因
D. 离子键一定只存在于离子化合物中,共价键一定只存在于共价化合物中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于油脂的叙述错误的是
A. 油脂由C、H、O三种元素组成
B. 油脂在碱性条件下不能发生水解反应
C. 天然油脂的主要成份是高级脂肪酸甘油酯
D. 工业上可以用油脂制造肥皂等化工产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示, 列有关绿原酸的说法正确的是( )
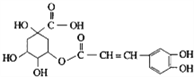
A. 绿原酸的分子式为C16H16O9 B. 1mol绿原酸最多与4molNaOH反应
C. 1个绿原酸分子中含有3个手性碳原子 D. 绿原酸分子中有4种化学环境不同的氢原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com