
【题目】T℃时,向2 L恒容密闭容器中充入1 mol NO2与2 mol SO2发生如下反应:
NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1。
SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1。
(1)下列能说明该反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗n mol SO3的同时生成n mol NO2
(2)反应进行到20 s 时,测得反应速率v(NO) = 0.005 mol·L-1·s-1,则消耗的NO2为 mol。
(3)下列措施能使反应加快的是 (仅改变一个条件)
a.降低温度 b.缩小容积 c.使用效率更高的催化剂
(4)若上述容器为绝热容器(与外界无热交换),则到达平衡所需时间将 。
a.延长 b.缩短 c.不变 d.无法确定
【答案】(1)b ;(2)0.2 ;(3)b、c ;(4)b。
【解析】
试题分析:反应NO2(g)+SO2(g) ![]() SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1是反应前后气体体积不变的放热反应。a.由于反应前后气体的体积不变,因此无论反应是否达到平衡,体系压强都保持不变,故不能据此判断反映是否处于平衡状态,错误;b.在混合气体中只有NO2是有色气体,因此混合气体颜色保持不变,则证明反应处于平衡状态,正确;c.SO3和NO都是生成物,二者的物质的量的比就是方程式的系数比,因此二者的体积积比保持不变不能判断反应处于平衡状态,错误;d.每消耗n mol SO3的同时生成n mol NO2,这都表示反应逆向进行,因此不能证明反应处于平衡状态,错误。(2)反应进行到20 s 时,测得反应速率v(NO) = 0.005 mol·L-1·s-1,由于v(NO2):v(NO)=1:1,所以反应消耗的NO2的物质的量是为n(NO2) = 0.005 mol·L-1·s-1×2 L×20s=0.2mol;(3)a.降低温度,反应速率减慢,错误;b.缩小容积,物质的浓度增大,反应速率加快,正确;c.使用效率更高的催化剂,可以是化学反应速率大大加快,正确。(4)该反应为放热反应,容器绝热会使容器内温度升高,反应速率加快,到达平衡的时间缩短,故b正确。
SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1是反应前后气体体积不变的放热反应。a.由于反应前后气体的体积不变,因此无论反应是否达到平衡,体系压强都保持不变,故不能据此判断反映是否处于平衡状态,错误;b.在混合气体中只有NO2是有色气体,因此混合气体颜色保持不变,则证明反应处于平衡状态,正确;c.SO3和NO都是生成物,二者的物质的量的比就是方程式的系数比,因此二者的体积积比保持不变不能判断反应处于平衡状态,错误;d.每消耗n mol SO3的同时生成n mol NO2,这都表示反应逆向进行,因此不能证明反应处于平衡状态,错误。(2)反应进行到20 s 时,测得反应速率v(NO) = 0.005 mol·L-1·s-1,由于v(NO2):v(NO)=1:1,所以反应消耗的NO2的物质的量是为n(NO2) = 0.005 mol·L-1·s-1×2 L×20s=0.2mol;(3)a.降低温度,反应速率减慢,错误;b.缩小容积,物质的浓度增大,反应速率加快,正确;c.使用效率更高的催化剂,可以是化学反应速率大大加快,正确。(4)该反应为放热反应,容器绝热会使容器内温度升高,反应速率加快,到达平衡的时间缩短,故b正确。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】(1)某元素最高化合价为+5,原子最外层电子数为2,半径是同族中最小 的,其核外电子排布式为______,价电子构型为______,属________区元素。
(2)某元素原子的价电子构型为4s24p1,它属于第________周期________族,最高正化合价为________,元素符号是________。
(3)原子序数为24的元素原子中有________个电子层,________个能级,________个未成对电子。
(4)请写出有2个能层的p轨道中只有一个未成对电子的基态原子的外围电子排布图(有几个写几个)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以获得淡水、食盐,并可提取镁和溴等物质。
(1)海水淡化的方法有_______(填一种)。
(2)写出元素钠在元素周期表中的位置:_______。
(3)从海水中提取镁的流程如下图所示:
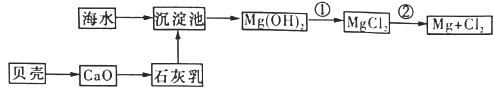
反应①的离子方程式为_______________。
反应②的化学方程式为_______________。
(4)从海水中提取溴的主要步骤是向浓缩的海水中通人氯气,将溴离子氧化,该反应的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015上海卷】实验室回收废水中苯酚的过程如右图所示。下列分析错误的是( )
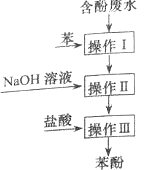
A.操作I中苯作萃取剂
B.苯酚钠在苯中的溶解度比在水中的大
C.通过操作II苯可循环使用
D.三步操作均需要分液漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【东北三省四市教研联合体2017届高三高考模拟试】已知有机物A. B之间存在转化关系:A(C6H12O2) +H2O![]() B+HCOOH(已配平)则符合该反应条件的有机物B有(不含立体异构)
B+HCOOH(已配平)则符合该反应条件的有机物B有(不含立体异构)
A. 6种 B. 7种 C. 8种 D. 9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝硅合金材料性能优良。铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)干法制取该合金的工艺如下:

(1)若湿法处理铝土矿,用强酸浸取时,所得溶液中的金属阳离子有_______。
(2)焙烧除铁反应:4(NH4)2SO4 + Fe2O3 ![]() 2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为______。指出气体Ⅰ的用途__________________(任写一种)。
2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为______。指出气体Ⅰ的用途__________________(任写一种)。

(3)操作①包括:加水溶解、_______。若所得溶液中加入过量NaOH溶液,含铝微粒发生反应的离子方程式为____________________。
(4)用焦炭还原SiO2、Al2O3会产生中间体SiC、Al4C3,任写一个高温下中间体又与Al2O3反应生成铝、硅单质的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)沧州铁狮酒的主要成分是我们学习的有机物——乙醇,请写出乙醇分子的官能团的名称______,该官能团的电子式______。我们还学习了与乙醇结构相似的一系列有机物如:
A.CH3OH B.(CH3)3CCH2OH C.(CH3)3COH D.(CH3)2CHOH等有机物。(填字母)
①能氧化成醛的是____________②不能发生消去反应形成烯的是_________③能氧化成酮的是_____
(2)下列实验不能达到预期目的的是__________
A.实验室用无水乙醇加热至170℃,可制得乙烯
B.只用新制氢氧化铜悬浊液可将乙醇.乙醛.乙酸三种液体区别出来
C.在混有杂质苯酚的苯中.加入适量溴水.过滤后得到纯净的苯
D.在10%的NaOH溶液中滴入2%的CuSO4溶液至过量.再加入乙醛溶液加热至沸腾.溶液中有红色沉淀产生
E.用饱和Na2CO3溶液除去乙酸乙酯中混有的乙酸
F.将溴乙烷与NaOH溶液共热几分钟后冷却,滴入AgNO3溶液,观察沉淀颜色,可用来检验溴乙烷中溴元素的存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com