
【题目】下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将SO2气体通入酸性KMnO4溶液 | 溶液褪色 | SO2具有漂白性 |
B | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 有白色沉淀产生,苯层呈紫红色 | Cu2+有氧化性,白色沉淀可能为CuI |
C | 向蛋白质溶液中分别加入甲醛、(NH4)2SO4饱和溶液 | 均有白色沉淀生成 | 蛋白质均发生了变性 |
D | 向5 mL 0.1 mol·L1 KI溶液中加入1 mL 0.1 mol·L1 FeCl3溶液,振荡,用苯萃取2~3次后,取下层溶液滴加5滴KSCN溶液 | 出现血红色 | 反应2Fe3++2I |
A.AB.BC.CD.D
【答案】BD
【解析】
A. SO2气体通入酸性KMnO4溶液,溶液褪色,是因为SO2具有还原性,SO2与酸性KMnO4发生氧化还原反应而使酸性KMnO4溶液褪色,A项错误;
B.CuSO4溶液中加入KI溶液,发生氧化还原反应生成碘单质和CuI,则现象为有白色沉淀生成,苯层呈紫红色,B项正确;
C.蛋白质溶液中加入(NH4)2SO4饱和溶液产生白色沉淀,是蛋白质发生盐析,而加入甲醛,是蛋白质变性,C项错误;
D.向5 mL 0.1 mol·L1 KI溶液中加入1 mL 0.1 mol·L1 FeCl3溶液,发生反应2Fe3++2I![]() 2Fe2++I2,I过量,滴加5滴KSCN溶液,出现血红色,说明有Fe3+剩余,则说明反应2Fe3++2I
2Fe2++I2,I过量,滴加5滴KSCN溶液,出现血红色,说明有Fe3+剩余,则说明反应2Fe3++2I![]() 2Fe2++I2是有一定限度的,D项正确。
2Fe2++I2是有一定限度的,D项正确。
答案选BD。


科目:高中化学 来源: 题型:
【题目】以苯酚为原料合成 ![]() 的路线如图所示。请按要求作答
的路线如图所示。请按要求作答

(1)写出苯酚制取A的有机物的有关反应方程式:______。
(2)写出以下物质的结构简式:B__________,F____________。
(3)写出反应④的化学反应方程式:④________,反应类型:_____。
(4)反应⑤可以得到E,同时可能得到的副产物的结构简式为_______。
(5)写出反应⑦的反应条件:__________,_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】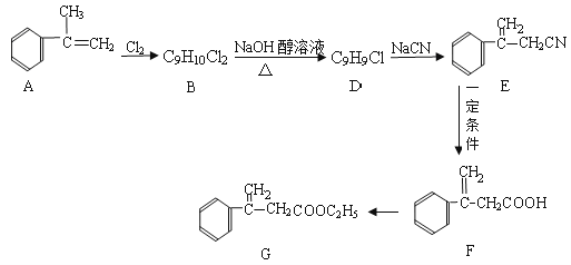
(1)F的官能团名称____________;
(2)B→D的化学反应方程式为______;
(3)D→E的化学反应类型为___________;
(4)F转化为G的化学反应方程式为_______;
(5)H是F的同分异构体,它是苯的邻位二取代物,遇FeCl3溶液显示特征颜色,则H可能的结构简式为(任写一种)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告提出要对环境问题进行全面、系统的可持续治理。绿色能源是实施可持续发展的重要途径,利用生物乙醇来制取绿色能源氢气的部分反应过程如下图所示:
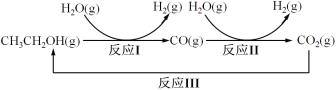
(1)已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H1= - 41 kJ/mol
CO2(g)+H2(g) △H1= - 41 kJ/mol
CH3CH2OH(g)+3H2O(g)![]() 2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
2CO2(g)+6H2(g) △H2=+174.1 kJ/mol
请写出反应I的热化学方程式_____________________________。
(2)反应II,在进气比[n(CO) : n(H2O)]不同时,测得相应的CO平衡转化率见下图
(各点对应的反应温度可能相同,也可能不同;各点对应的其他反应条件都相同)。

① 经分析,A、E和G三点对应的反应温度相同,其原因是KA=KE=KG=________(填数值)。在该温度下:要提高CO平衡转化率,除了改变进气比之外,还可采取的措施是________。
② 对比分析B、E、F三点,可得出对应的进气比和反应温度的变化趋势之间的关系是_____________________________________________________________。
③ 比较A、B两点对应的反应速率大小:VA______VB(填“<” “=”或“>”)。反应速率v=v正-v逆=![]() -
-![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算在达到平衡状态为D点的反应过程中,当CO转化率刚好达到20%时![]() =__________ (计算结果保留1位小数)。
=__________ (计算结果保留1位小数)。
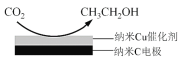
(3)反应III,利用碳酸钾溶液吸收CO2得到饱和的KHCO3电解液,电解活化的CO2来制备乙醇。
①已知碳酸的电离常数Ka1=10-a,Ka2=10-b,吸收足量CO2所得饱和KHCO3溶液的pH=c,则该溶液中lg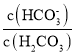 =____________________________________(列出计算式)。
=____________________________________(列出计算式)。
②在饱和KHCO3电解液中电解CO2来制备乙醇的原理如图所示。则阴极的电极反应式是_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,其结构如下图。下列有关该物质的说法不正确的是
![]()
A. 分子式为C3H4O3B. 分子中σ键与π键个数之比为3:1
C. 分子中既有极性键也有非极性键D. 分子中碳原子的杂化方式全部为sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
a | 原子核外电子分别占3个不同能级,且每个能级上排布的电子数相同 |
b | 基态原子的p轨道电子数比s轨道电子数少1 |
c | 在周期表所列元素中电负性最大 |
d | 位于周期表中第4纵行 |
e | 基态原子M层全充满,N层只有一个电子 |
请回答:
(1)d属于________区的元素,其基态原子的价电子排布图为_________。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为________(用元素符号表示)。
(3)c的氢化物水溶液中存在的氢键有________种,任意画出一种________。
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为________(用化学式表示)。若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为________;A的中心原子的轨道杂化类型为________;与A互为等电子体的一种分子为________(填化学式)。
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为________,若该晶体的相对分子质量为M,密度为ag/cm![]() ,则晶胞的体积为________(NA用表示阿伏加德罗常数的值)。
,则晶胞的体积为________(NA用表示阿伏加德罗常数的值)。
(6)a形成的某种单质的层状结构如图,其中a原子数、a—a键数、六元环数之比为____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1molN2O4充入容积固定为2 L的密闭容器中,发生反应:N2O4![]() 2NO2(g)。经2s达到化学平衡状态,此时测得容器中c(NO2)=0.2mol/L。
2NO2(g)。经2s达到化学平衡状态,此时测得容器中c(NO2)=0.2mol/L。
(1)下列说法中,一定能说明该反应达到平衡状态的是_________(填序号)。
A.正、逆反应均已停止 B. v(NO2)=2v(N2O4)
C.容器中 c(NO2) : c(N2O4)=2∶1 D.混合气体的密度不变
E.混合气体的压强不变 F.混合气体的颜色不变
(2)0~2 s内反应的平均速率v(NO2)=___________________。
(3)达到平衡时容器中c(N2O4)=______________________。
(4)达到平衡时,N2O4转化率为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X的蒸气相对氢气的密度为51,X中氧元素的质量分数为31.7%,则能在碱性溶液中发生反应的X的同分异构体有(不考虑立体异构)( )
A. 12种B. 13种C. 14种D. 15种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是
A. 某溶液![]() 有白色沉淀,说明原溶液中有Cl-
有白色沉淀,说明原溶液中有Cl-
B. 某溶液![]() 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-
C. 某溶液![]() 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+
D. 某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com