
【题目】球墨铸铁中含有一种铁碳化合物X。实验室测定化合物X的组成实验如下:

下列说法不正确的是
A.固体2是Fe2O3
B.溶液甲中可能含有Fe3+
C.X的化学式可以表示为Fe3C2
D.X与足量的热浓硝酸反应有NO2和CO2生成
【答案】C
【解析】
铁碳化合物X,在足量空气中煅烧得固体1为铁的氧化物,可以有+2价或+3价的铁,溶于盐酸所得溶液中可能Fe2+和Fe3+,再通入足量的氯气,溶液中都为+3价的铁,加热蒸发,铁离子水解,生成氢氧化铁,灼烧后氢氧化铁分解得固体2为氧化铁,24g氧化铁中含有铁元素的质量为24g×![]() =16.8g,利用元素守恒,可计算得化合物X中铁元素的质量也是16.8g,进而求得X中碳元素的质量为18g-16.8g=1.2g,所以在X中铁、碳原子的物质的量之比为
=16.8g,利用元素守恒,可计算得化合物X中铁元素的质量也是16.8g,进而求得X中碳元素的质量为18g-16.8g=1.2g,所以在X中铁、碳原子的物质的量之比为![]() :
:![]() =3:1,所以X的化学式为Fe3C,Fe3C与热的浓硝酸发生氧化还原反应,碳元素可被氧化成二氧化碳,硝酸中的氮可被还原成二氧化氮,根据上面的分析可知。
=3:1,所以X的化学式为Fe3C,Fe3C与热的浓硝酸发生氧化还原反应,碳元素可被氧化成二氧化碳,硝酸中的氮可被还原成二氧化氮,根据上面的分析可知。
A、固体2是氧化铁,故A正确;
B、溶液甲中可能含有Fe3+,故B正确;
C、X的化学式可以表示为Fe3C,故C错误;
D、X与足量的热浓硝酸反应有NO2和CO2生成,故D正确;
故选C。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】解释下列事实所用的方程式不合理的是
A.硫酸酸化的KI淀粉溶液久置后变蓝:4I-+O2 +4H+=2I2+2H2O
B.NaHCO3溶液显碱性:HCO3-+H2OCO32-+OH-
C.用Na2CO3溶液处理锅炉水垢中的硫酸钙:CO32- +CaSO4 =CaCO3 +SO42-
D.氨水显碱性:NH3·H2ONH4++OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次递增,其中Y与Z同主族。X与Y、Z与W均可形成如图所示的分子结构,且Z与W形成的分子中所有原子最外层均满足8电子稳定结构。下列说法中正确的是

A.原子半径:W > Z > Y > X
B.气态氢化物热稳定性:Y > Z > W
C.元素Z和W均存在两种以上的含氧酸
D.元素Z和W在自然界中均只能以化合态存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过褪色所需时间来判断反应的快慢。该小组设计了如下方案:
实验编号 | H2C2O4溶液 | 酸性KMnO4 | 温度 | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||
0.10 | 2.0 | 0.010 | 4.0 | 25 | |
0.20 | 2.0 | 0.010 | 4.0 | 25 | |
0.20 | 2.0 | 0.010 | 4.0 | 50 | |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥__。
(2)试验编号②和③探究的内容是____。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时同内平均反应速率v(KMnO4)=___mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非索非那定(化合物H)是一种重要的抗过敏药,其部分合成路线如下:
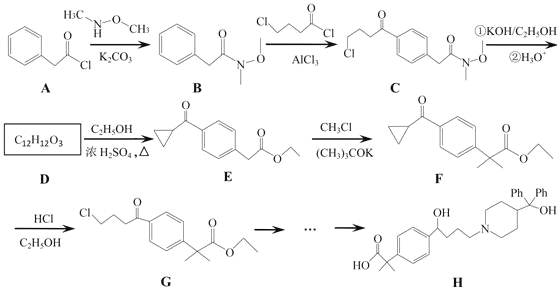
(1)B→C的反应类型为_______,E分子中含氧官能团有_______(写名称)。
(2)D的结构简式为_________。
(3)F→G反应的化学方程式为__________。
(4)清写出一种同时满足下列条件的B的同分异构体的结构简式:____________。
①苯环上有3个取代基;②具有a-氨基酸结构;③有6种不同化学环境的氢原子。
(5) 是一种重要的有机合成中间体,请完成乙苯乙烯为主要原料(其他试剂自选)合成该化合物的合成路线流程图__________。合成路线流程图示例如下
是一种重要的有机合成中间体,请完成乙苯乙烯为主要原料(其他试剂自选)合成该化合物的合成路线流程图__________。合成路线流程图示例如下![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】教材采用图1实验装置测定锌与稀硫酸反应的速率。

(1)检查图1装置气密性的操作方法是___。
(2)分别取2g颗粒大小相同的锌粒分别与体积均为40mL的1mol/L硫酸、4mol/L硫酸反应,收集25mLH2时所需时间后者比前者___。
(3)同学们在实验操作中发现本实验设计存在明显不足,例如___。
(4)某化学兴趣小组对教材实验装置进行图2所示改进。检查装置气密性后进行的实验操作有:
a.在多孔塑料袋中装入锌粒;
b.在锥形瓶中加入40mL1mol/L硫酸;
c.塞好橡胶塞,___时立即用秒表计时;
d.注射器内每增加5mL气体时读取一次秒表。
(5)实验观察到锌与稀硫酸反应初期速率逐渐加快,其原因是___,反应进行一定时间后速率逐渐减慢,原因是___。
(6)测得产生H2的体积与反应时间的关系曲线如图3所示,t1~t2时间段氢气体积略有减小的原因是___;在64s内用H+浓度表示的平均反应速率v(H+)=___(此时,溶液体积仍为40mL,气体摩尔体积为25L/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在120℃,常压下,取1L该混合烃在3.5L氧气中完全燃烧,恢复到原状态,测得气体体积为4.5L,则符合该条件的烃的组合是
A.CH4、C3H6B.CH4、C2H4C.C2H4、C3H8D.C2H2、C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol/LNaOH溶液分别滴定20.00mL浓度均为0.10mol/LCH3COOH溶液和HCN溶液所得滴定曲线如图[Ka(CH3COOH)>K(HCN)]。下列说法正确的是( )
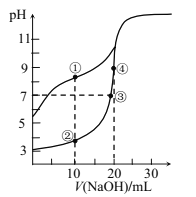
A.点①和点②所示溶液中:c(CH3COO-)<c(CN-)
B.点③所示溶液中:c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D.点③和点④所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积为2L的密闭容器中充入2mol X,一定条件下可发生反应:2X(g)![]() 3Y(g),该反应的反应速率(v)与时间(t)的关系如图所示,已知
3Y(g),该反应的反应速率(v)与时间(t)的关系如图所示,已知![]() min时容器内有1.5mol Y。下列叙述正确的是( )
min时容器内有1.5mol Y。下列叙述正确的是( )

A. 若![]() min时升高温度,则反应速率不变
min时升高温度,则反应速率不变
B. ![]() ~
~![]() min内,
min内,![]() ,反应不再发生
,反应不再发生
C. 0~![]() min内,
min内,![]()
D. ![]() min时,只有正反应发生
min时,只有正反应发生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com