
【题目】教材采用图1实验装置测定锌与稀硫酸反应的速率。

(1)检查图1装置气密性的操作方法是___。
(2)分别取2g颗粒大小相同的锌粒分别与体积均为40mL的1mol/L硫酸、4mol/L硫酸反应,收集25mLH2时所需时间后者比前者___。
(3)同学们在实验操作中发现本实验设计存在明显不足,例如___。
(4)某化学兴趣小组对教材实验装置进行图2所示改进。检查装置气密性后进行的实验操作有:
a.在多孔塑料袋中装入锌粒;
b.在锥形瓶中加入40mL1mol/L硫酸;
c.塞好橡胶塞,___时立即用秒表计时;
d.注射器内每增加5mL气体时读取一次秒表。
(5)实验观察到锌与稀硫酸反应初期速率逐渐加快,其原因是___,反应进行一定时间后速率逐渐减慢,原因是___。
(6)测得产生H2的体积与反应时间的关系曲线如图3所示,t1~t2时间段氢气体积略有减小的原因是___;在64s内用H+浓度表示的平均反应速率v(H+)=___(此时,溶液体积仍为40mL,气体摩尔体积为25L/mol)。
【答案】关闭分液漏斗活塞,向外拉注射器的内管一段距离后松手,若内管能回到开始位置,证明气密性好,若不能则说明气密性不好 短 分液漏斗中溶液滴下占据体积引起气体体积读数误差或者收集25mLH2时所需时间间隔太短 多孔塑料袋浸入稀硫酸 反应放热,温度升高反应速率加快 酸中氢离子浓度减小 气体遇冷压缩 v(H+)=0.00125mol/(Ls)
【解析】
(1)检查图1装置气密性,可设法让装置内压强与外界压强不同,根据现象确定气密性情况。
(2)锌粒质量、表面积相同,但两份硫酸溶液中c(H+)不同,后者反应速率快,由此可确定收集25mLH2时所需时间的关系。
(3)同学们在实验操作中发现本实验设计存在明显不足,可从气体体积误差、产生H2时间间隔等分析。
(4)c.塞好橡胶塞,反应刚开始时立即用秒表计时;
(5)实验观察到锌与稀硫酸反应初期速率逐渐加快,从影响速率的外界因素寻找原因,反应进行一定时间后速率逐渐减慢,仍从影响速率的因素找原因。
(6) t1~t2时间段,反应已经结束,氢气体积略有减小,则与反应无关,只能从与反应无关的因素中寻找原因;在64s内用H+浓度表示的平均反应速率时,由H2的体积求其物质的量,然后再求出n(H+),最后求出v(H+)。
(1)检查图1装置气密性,可关闭分液漏斗活塞,向外拉注射器的内管一段距离后松手,若内管能回到开始位置,证明气密性好,若不能则说明气密性不好。答案为:关闭分液漏斗活塞,向外拉注射器的内管一段距离后松手,若内管能回到开始位置,证明气密性好,若不能则说明气密性不好;
(2)锌粒质量、表面积相同,但两份硫酸溶液中c(H+)不同,后者反应速率快,由此可确定收集25mLH2时所需时间后者比前者短。答案为:短;
(3)同学们在实验操作中发现本实验设计存在明显不足,可从气体体积误差、产生H2时间间隔等分析,例如分液漏斗中溶液滴下占据体积引起气体体积读数误差或者收集25mLH2时所需时间间隔太短。答案为:分液漏斗中溶液滴下占据体积引起气体体积读数误差或者收集25mLH2时所需时间间隔太短;
(4)c.塞好橡胶塞,反应刚开始时,即多孔塑料袋浸入稀硫酸时,立即用秒表计时。答案为:多孔塑料袋浸入稀硫酸;
(5)实验观察到锌与稀硫酸反应初期速率逐渐加快,因为c(H+)不断减小,所以只能是反应放热,温度升高反应速率加快;反应进行一定时间后速率逐渐减慢,则应为酸中氢离子浓度减小。答案为:反应放热,温度升高反应速率加快;酸中氢离子浓度减小;
(6) t1~t2时间段,反应已经结束,氢气体积略有减小,则应为气体遇冷压缩;H2的物质的量n(H2)=![]() =0.0016mol,n(H+)=2n(H2)=0.0032mol,v(H+)=
=0.0016mol,n(H+)=2n(H2)=0.0032mol,v(H+)=![]() =0.00125mol/(Ls)。答案为:气体遇冷压缩;0.00125mol/(Ls)。
=0.00125mol/(Ls)。答案为:气体遇冷压缩;0.00125mol/(Ls)。


科目:高中化学 来源: 题型:
【题目】NA 为阿伏加德罗常数的值。下列说法正确的是 ( )
A.18g![]() 和
和![]() 的混合物中,所含中子数为 10 NA
的混合物中,所含中子数为 10 NA
B.标准状况下,2.24L SO3 中含有的氧原子数目为 0.3 NA
C.物质的量浓度为 0.1molL﹣1 的 MgCl2 溶液中,含有 Cl﹣个数为 0.2 NA
D.一定条件下,2.3g 的金属钠完全与氧气反应时生成 3.6g 产物时失去的电子数为 0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁的电化学腐蚀原理如图所示,下列有关说法中错误的是( )
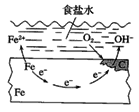
A. 铁片里的铁和碳与食盐水形成无数的微小原电池
B. 铁电极发生氧化反应
C. 负极的电极反应方程式为O2+4e-+2H2O=4OH-
D. 放置一段时间后,铁片上有铁锈出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于放热反应Zn+H2SO4=ZnSO4+H2↑,下列叙述正确的是( )

A. 反应过程中的能量关系可用上图表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则其能量转化形式为电能转化为化学能
D. 若将其设计为原电池,当有32.5gZn溶解时,正极放出的气体一定为11.2L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组化合物中,化学键类型和化合物类型均相同的是_________(填序号)。
A.CaCl2和 Na2S B.Na2O 和 Na2O2
C.CO2和CaO D.HC1 和 NaOH
(2)已知1 mol石墨转化为1 mol金刚石要吸收能量,则1 mol石墨的能量比1 mol金刚石的能量____(填“高”或“低”),石墨比金刚石_______(填“稳定”或“不稳定”)。
(3)Ba(OH)2 8H2O和NH4Cl反应的化学方程式是____________,该反应是___(填“吸热”或“放热”)反应,反应过程能量变化的图像符合_____________(填“图1”或“图2”)。
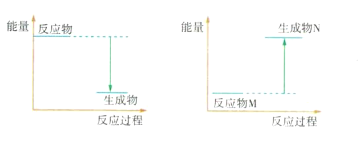
图1 图2
(4)如图3所示,把试管放入盛有饱和澄清石灰水(温度为25℃)的烧杯中,先在试管中放入几小块镁片,再用滴管滴入5mL盐酸。可以观察到烧杯中的石灰水逐渐由澄清变浑浊,出现这种现象的原因是___________________________。
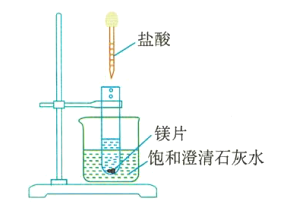
图3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示。根据该表,回答下列问题:
化学式 | HF | CH3COOH | H2SO3 | H2CO3 | H2S |
电离平衡 常数(Ka) | 7.2×10-4 | 1.8×10-5 | K1=1.54×10-2 K2=1.02×10-7 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
(1)同浓度的F-、CO32-、CH3COO-、HS-结合H+的能力最强的为__________
(2)溶液中不可能大量共存的离子组是__________
a.HS-、SO32- b.HF、CH3COO- c.HS-、HCO3- d. HSO3-、HCO3-
(3)Na2CO3溶液通入过量H2S的离子方程式是:___________。
(4)已知pH= -lgc(H+),体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中pH变化如图所示,则HX的电离平衡常数______醋酸的电离平衡常数(填“>”、“<”或“=”)。 任意写一种方法证明醋酸是弱电解质________________。

(5)向 0.l molL-1 HF 溶液中滴加 NaOH 溶液至c(HF) : c(F-) =5 : 36,此时溶液pH = _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国核物理研究所的科学家实验发现,植物和落叶都能产生甲烷,其生成随着温度和日照的增强而增加。甲烷(CH4 )在足量O2中完全燃烧产生CO2和H2O(g) ,该反应中各物质所含化学键键能如图所示(键能是气态基态原子形成1 mol化学键释放的最低能量,单位为kJ·mol 1)。下列说法错误的是

A.甲烷在氧气中燃烧的反应为放热反应
B.O=O键的键能比C=O键的键能小
C.1 mol甲烷在足量氧气中燃烧产生的H2O(g)所含化学键的能量为1856 kJ
D.1 mol CH4所含化学键的能量比1 mol CO2所含化学键的能量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016 年,《Nature》期刊报道一例CH3OH-O2在聚合物催化下的原电池,其工作示意图如下。下列说法正确的是
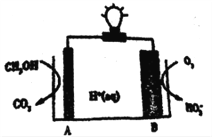
A. 电极B的电极反应为:O2+2e-+H+=HO2- B. 电解质溶液中H+由电极B流向A极
C. 电极A是负极,发生还原反应 D. 外电路中通过3mol电子,生成CO211.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把aL含硫酸铵和硝酸铵的混合液分成2等份,一份需用bmol烧碱刚好把铵全部反应,另一份与氯化钡溶液反应时,消耗cmol氯化钡。由此可知原溶液中NO3-离子的物质的量浓度为(单位:mol·L-1)
A.![]() mol/LB.
mol/LB.![]() mol/L
mol/L
C.![]() mol/LD.
mol/LD.![]() mol/L
mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com