
| A、在有机化工中,氯气是合成塑料、橡胶、人造纤维、农药、染料和药品的重要原料 |
| B、“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 |
| C、白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 |
| D、汽车尾气中含有氮的氧化物,是汽油不完全燃烧造成的 |
| ||
| ||


科目:高中化学 来源: 题型:
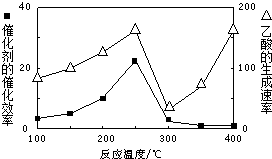
| A、酯化反应的实质是酸与醇反应生成水,与中和反应相似 |
| B、醇与所有酸的反应都是酯化反应 |
| C、有水生成的醇与酸的反应并非都是酯化反应 |
| D、两个羟基去掉一分子水的反应就是酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
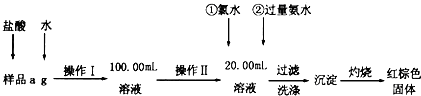
| A、将Al2(SO4)3溶液蒸干、灼烧至恒重,最终剩余固体是Al2O3 |
| B、将某气体通入品红溶液中,品红溶液褪色,则此气体一定是SO2 |
| C、取少许某溶液,滴加数滴KSCN溶液,无明显现象;再另取少许原溶液,先滴少量新制氯水,再滴加数滴KSCN溶液,溶液变血红色,则原溶液中一定含Fe2+ |
| D、在淀粉溶液中加入稀硫酸并加热片刻后,再加入适量银氨溶液,水浴加热后没有银镜生成,说明淀粉没有水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硝酸是易挥发的强酸 |
| B、纯碱溶液能使酚酞溶液品红色 |
| C、CO是无色难溶于水的气体 |
| D、Fe3+可以与KSCN溶液反应生成血红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、安装煤炭“固硫”装置,降低酸雨发生率 |
| B、日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
| C、研发易降解的塑料,防止白色污染 |
| D、氮的固定只有在高温、高压、催化剂的条件下才能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.| 温度 | 200℃ | 250℃ | 300℃ |
| K | 56 | 64 | 80 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com