
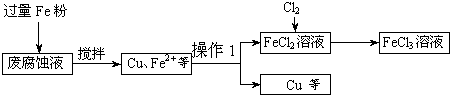
 KCl+3Cl2↑+3H2O,
KCl+3Cl2↑+3H2O, KCl+3Cl2↑+3H2O;
KCl+3Cl2↑+3H2O; ,故答案为:
,故答案为: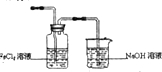 ;
; KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
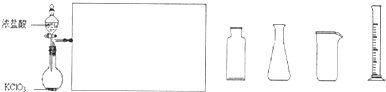
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012届山东省潍坊市高三上学期期末考试化学试卷 题型:实验题
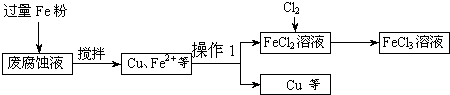
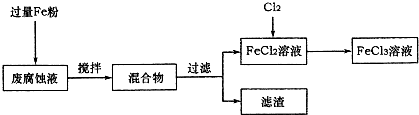
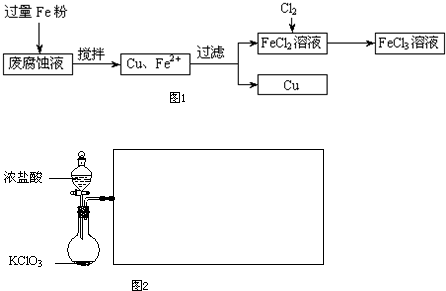
(16分)印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
(1)测得某废腐蚀液中含CuCl2 1.5 mol·L-1、FeCl23.O mol·L-1、FeCl3 1.0 mol·L-1、HCl3.0 mol·L-1。取废腐蚀液200mL按如下流程在实验室进行实验:
回答下列问题:
废腐蚀液中加入过量铁粉后,发生反应的离子方程式为 。
②检验废腐蚀液中含有Fe3+的实验操作是 ;
在上述流程中,“过滤”用到的玻璃仪器有烧杯、玻璃棒、 。
③由滤渣得到纯铜,除杂所需试剂是 。
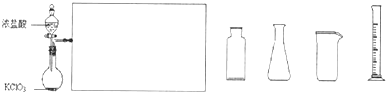
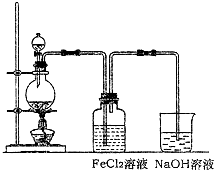
(2)某化学兴趣小组利用下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。
①实验开始前,某同学对实验装置进行了气密性检查,方法是 。
②浓盐酸与二氧化锰反应的化学方程式为 ;
烧杯中NaOH溶液的作用是 。
③参考(1)中数据,按上述流程操作,需称取Fe粉的质量应不少于 g,
需通入Cl2的物质的量应不少于 mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com