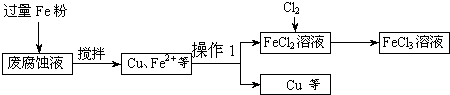
(2011?百色模拟)印刷电路的废腐蚀液含有大量CuC1
2、FeC1
2和FeC1
3,任意排放将导致环境污染及资源的浪费.可从该废液中回收铜,并将铁的化合物全部转化为FeCl
3溶液,作为腐蚀液原料循环使用.测得某废腐蚀液中含CuCl
2 1.5mol/L、FeCl
2 3.0mol/L、FeCl
3 1.0mol/L、HCl 3.0mol/L.取废腐蚀液200mL按如下流程在实验室进行实验:
回答下列问题:
(1)上述方法获得的铜粉中含有杂质,除杂质所需试剂是
HCl
HCl
(填化学式).
(2)实验室可用固体KClO
3与浓HCl反应制备Cl
2,此反应中Cl
2既是氧化产物,又是还原产物.反应的化学方程式为
.
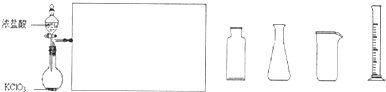
(3)如图是实验室制备Cl
2并通入FeCl
2溶液中获得FeCl
3溶液的部分装置.
从图中挑选所需的仪器,完成上述装置简图(添加必要的塞子、玻璃导管、胶皮管.固定装置不用画),并标明容器中所装试剂.
(4)实验中,必需控制氯气的速度,使导管口逸出的气泡每秒1~2个,以便被FeCl
2溶液完全吸收.控制生成氯气速率的操作是:
缓慢旋转分液漏斗的活塞,调节浓盐酸滴下的速度
缓慢旋转分液漏斗的活塞,调节浓盐酸滴下的速度
.
(5)按上述流程操作,需称取Fe粉的质量应不少于
39.2
39.2
g(精确到0.1g),需通入Cl
2的物质的量不少于
0.75
0.75
mol,加入烧瓶中的KClO
3的质量应不少于
30.6
30.6
g(精确到0.1g).



 ,故答案为:
,故答案为: ;
;

 名校课堂系列答案
名校课堂系列答案 (2011?百色模拟)大豆异黄酮(结构如图)是一种近年来引起营养与医学界广泛关注的物质,它对于人体健康有着重要的作用.关于大豆异黄酮的叙述错误的是( )
(2011?百色模拟)大豆异黄酮(结构如图)是一种近年来引起营养与医学界广泛关注的物质,它对于人体健康有着重要的作用.关于大豆异黄酮的叙述错误的是( )